Валентность марганца
Общие сведения о валентности марганца
Марганец – серебристо-белый металл. Плотность – 7,44 г/см3. Температуры плавления и кипения равны 1245oС и 2080oС, соответственно. Известны четыре кристаллические модификации марганца, каждая из которых устойчива в определенном интервале температур. Так, например, при температуре ниже 707oС устойчив α-марганец, имеющий сложную структуру – в его элементарную ячейку входят 58 атомов.
Валентность марганца в соединениях
Марганец находится в четвертом периоде в VIIB группе Периодической таблицы Д.И. Менделеева. Порядковый номер равен 25. В ядре атома марганца содержится 25 протонов и 31 нейтрон (массовое число равно 56). В атоме марганца есть четыре энергетических уровня, на которых находятся 25 электронов (рис. 1).
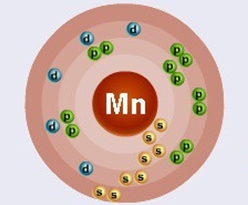
Рис. 1. Строения атома марганца.
Электронная формула атома марганца в основном состоянии имеет следующий вид:
1s22s22p63s23p63d54s2.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
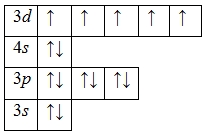
Наличие пяти неспаренных электронов свидетельствует о том, что марганец в своих соединениях может проявлять валентность V, однако эти вещества неустойчивы и быстро разлагаются.
Атом марганца способен переходить в возбужденное состояние: электроны 4s-подуровня распариваются и один из них занимает вакантную орбиталь 4p-подуровня:
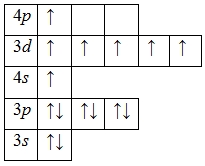
Наличие семи неспаренных электронов свидетельствует о том, что марганец в своих соединениях также может проявлять валентность VII (высшая) (MnVII2O7, MnVIIO3F).
Известно, что для марганца также характерны валентности II (MnIIO, MnII(OH)2, MnIICl2, MnIIS, MnIICO3, MnII3(PO4)2), IV (MnIVO2) и VI(MnVIF6, MnVIOF4, MnVIO3).
Примеры решения задач
| Задание | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
MnO2 → Mn → MnCl2 → Mn(OH)2 →Mn(NO3)2. |
| Ответ | Марганец можно получить алюминотермическим методом, который заключается в осуществлении двух нижеуказанных реакций:
4MnO2 = 2Mn2O3 + O2; Mn2O3 + 2Al = 2Mn + Al2O3. При взаимодействии марганца с соляной кислотой образуется хлорид марганца (II): Mn + HCl2→ MnCl2 + H2↑. Реагируя со щелочью хлорид марганца (II) образует гидроксид магния: MnCl2 + 2NaOH → Mn(OH)2 + 2NaCl. Гидроксид марганца (II) вступает в реакцию нейтрализации с азотной кислотой с образованием нитрата марганца (II) и воды: Mn(OH)2 + 2HNO3 → Mn(NO3)2 + 2H2O. |
| Задание | Вычислите массу перманганата калия, который необходим для окисления сульфита калия массой 7,9 г в нейтральной среде. |
| Решение | Запишем уравнение реакции окисления сульфита калия перманганатом калия в нейтральной среде:
2KMnO4 + 3K2SO3 + H2O = 2MnO2 + 3K2SO4 + 2KOH. Рассчитаем число моль сульфита калия (молярная масса – 158 г/моль): n = m / M; n (K2SO3) = m (K2SO3) / M (K2SO3); n (K2SO3) = 7,9 / 158 = 0,05моль. Согласно уравнению реакции n(K2SO3) :n(KMnO4) = 3:2, значит, n(KMnO4) = 2/3 × n(K2SO3) = 2/3 × 0,03 = моль. Масса перманганата калия необходимого для окисления сульфита калия в нейтральной среде равна (молярная масса – 158г/моль): m = n × M; m (KMnO4) = n (KMnO4) × M (KMnO4); m (KMnO4) = 0,03 × 158 = 4,74 г. |
| Ответ | Масса перманганата калия равна 4,74 г. |











