Степень окисления в H2O
Общие сведения о воде и степени окисления в H2O
Стандартная энергия Гиббса образования жидкой воды при температуре 298 Л рана – 237, 57кДж/моль, водяного пара – 228,94 кДж/моль. В этой связи константа диссоциации водяного пара на водород и кислород очень мала (8,88×10-41).
Агрегатное состояние воды определяется температурой и давлением (рис. 1). Кривая АО соответствует равновесию в системе лед-пар, DO – равновесию в системе переохлажденная вода-пар, кривая OC – равновесию в системе вода-пар, а кривая OB – равновесию в системе лед-вода. В точке О все кривые пересекаются. Эта точка называется тройной точкой и отвечает равновесию в системе лед-вода-пар.
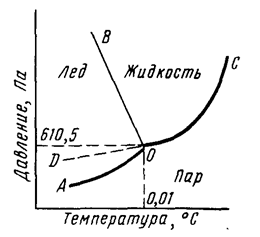
Рис. 1. Диаграмма состояния воды.
H2O, степени окисления элементов в ней
Вода – это по сути оксид водорода, а, как известно, степень окисления кислорода в составе оксидов всегда равна (-2). Для нахождения степени окисления водорода примем её значение за «х» и определим его при помощи уравнения электронейтральности:
2×х + (-2) = 0;
2х — 2 = 0;
2х = 2;
x = + 1.
Значит степень окисления водорода в воде равна (+ 1):
H+12O-2.
Примеры решения задач
| Задание | Определите степени окисления хрома в следующих соединениях: а) CrO; б) Na2CrO4; в) Cr2(SO4)3. |
| Ответ | а)Степень окисления кислорода в составе оксидов всегда равна (-2). Для нахождения степени окисления хрома примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + (-2) = 0; x — 2 = 0; x = +2. Степень окисления хрома в оксиде хрома (II) равна (+2): Cr+2O. б)Степень окисления натрия постоянна и определяется номером группы Периодической системы Д.И. Менделеева, в которой он расположен, со знаком минус, т.е. она равна (+1) (натрий – металл). Степень окисления кислорода, входящего в состав кислот, а, следовательно, и их остатков всегда равна (-2). Для нахождения степени окисления хрома примем её значение за «х» и определим его при помощи уравнения электронейтральности: 2× (+1) + х + 4× (-2) = 0; 2 + х — 8= 0; x — 6= 0; x = +6. Степень окисления хрома в хромате натрия равна (+6): Na2Cr+6O4. в)Степень окисления кислотного остатка определяется числом атомов водорода, входящих в состав образующей его кислоты, указанных со знаком минус. Сульфат-ион – это кислотный остаток серной кислоты, формула которой H2SO4. В её составе имеется два атома водорода, следовательно, степень окисления сульфат-ионе равна (-2). Степень окисления кислорода в составе кислот, а, следовательно, и их остатков равна (-2). Для нахождения степени окисления серы в составе сульфат-иона примем её значение за «х» и определим его при помощи уравнения электронейтральности: x + 4× (-2) = -2; x — 8 = -2; x = +6. Степень окисления хрома найдем аналогичным образом: 2×у + 3× (+6) + 12× (-2) = 0; 2у + 18 – 24= 0; 2у -6 = 0; 2у = + 6; y= +3. Степень окисления хрома в сульфате хрома (III) равна (+3): Cr+32(SO4)3. |
| Задание | Определите степени окисления хрома в следующих соединениях: а) Cr(OH)3; б) Cr; в) K2Cr2O7. |
| Ответ | а)Степени окисления водорода и кислорода, входящих в состав гидроксильной группы равны (+1) и (-2) соответственно, в связи с чем её суммарный заряд (-1). Для нахождения степени окисления хрома примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 3× (-2) + 3× (+1) = 0; x — 6+ 3= 0; x — 3= 0; x = +3. Степень окисления хрома в гидроксиде хрома (III) равна (+2): Cr+3(OH)3. б)Степень окисления металлов в элементарном состоянии равна нулю, так как распределение электронной плотности в них равномерно: Cr0. в)Степень окисления калия постоянна и определяется номером группы Периодической системы Д.И. Менделеева, в которой он расположен, со знаком минус, т.е. она равна (+1) (калий – металл). Степень окисления кислорода, входящего в состав кислот, а, следовательно, и их остатков всегда равна (-2). Для нахождения степени окисления хрома примем её значение за «х» и определим его при помощи уравнения электронейтральности: 2× (+1) + 2×х + 7× (-2) = 0; 2 + 2х — 14= 0; 2х — 12= 0; x = +6. Степень окисления хрома в дихромате калия равна (+6): K2Cr+62O7. |











