Строение атома стронция
Общие сведения о строении атома стронция
Относится к элементам s-семейства. Металл. Обозначение – Sr. Порядковый номер – 38. Относительная атомная масса – 87,62 а.е.м.
Электронное строение атома стронция
Атом стронция состоит из положительно заряженного ядра (+38), внутри которого есть 38 протонов и 50 нейтронов, а вокруг, по пяти орбитам движутся 38 электронов.
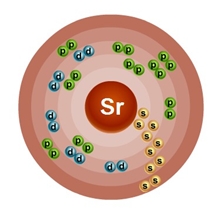
Рис.1. Схематическое строение атома стронция.
Распределение электронов по орбиталям выглядит следующим образом:
+38Sr)2)8)18)8)2;
1s22s22p63s23p63d104s24p65s2.
Внешний энергетический уровень атома стронция содержит 2 электрона, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:

Валентные электроны атома стронция можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
n |
l |
ml |
s |
|
s |
5 |
0 |
0 |
+1/2 |
|
s |
5 |
0 |
0 |
-1/2 |
Примеры решения задач
| Задание | Укажите какую атомную орбиталь и почему выберет очередной электрон согласно принципу наименьшей энергии: 3d или 4p, 5s или 4d, 4s или 3p, 4d или 5p. |
| Ответ | Заполнение орбиталей электронами происходит в соответствии с принципом Паули, правилами Клечковского и Хунда. Сначала заполняются электроны с наименьшим значением суммы (n+l), где n-главное квантовое число, а l- орбитальное квантовое число. Если эта сумма для нескольких подуровней одинакова, первой заполняется орбиталь с наименьшим значением n.
Тогда, из двух орбиталей (в скобках указана сумма n+l) 3d (5)и 4p (5) первой будет заполняться 4p-орбиталь; из 5s(5) и 4d (6) – 5s-подуровень; из 4s (4)и 3p (4) – 3р-подуровень; из 4d (6)и 5p (6) — 4d –подуровень. |
| Задание | Какие из перечисленных подуровней не существуют: 2s, 4f, 2p, 3d, 1p, 2d, 1s, 3f? |
| Ответ | Не существует орбиталей типа 1p, 2d и 3f, поскольку на первом уровне может быть только один подуровень, на втором уровне – 2 подуровня. Четвертый (f-) подуровень появляется лишь у элементов, имеющих наибольшее главное квантовое число равное 4-м. |











