Строение атома селена
Общие сведения о строении атома селена
Относится к элементам p-семейства. Неметалл. Обозначение – Se. Порядковый номер – 34. Относительная атомная масса – 78,96 а.е.м.
Электронное строение атома селена
Атом селена состоит из положительно заряженного ядра (+34), внутри которого есть 34 протона и 45 нейтронов, а вокруг, по трем орбитам движутся 34 электрона.

Рис.1. Схематическое строение атома селена.
Распределение электронов по орбиталям выглядит следующим образом:
+34Se)2)8)18)6;
1s22s22p63s23p63d104s24p4.
Внешний энергетический уровень атома селена содержит 6 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
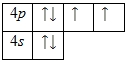
Каждый валентный электрон атома селена можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
n |
l |
ml |
s |
|
s |
4 |
0 |
0 |
+1/2 |
|
s |
4 |
0 |
0 |
-1/2 |
|
p |
4 |
1 |
-1 |
+1/2 |
|
p |
4 |
1 |
-1 |
-1/2 |
|
p |
4 |
1 |
0 |
+1/2 |
|
p |
4 |
1 |
1 |
+1/2 |
Наличие двух неспаренных электронов свидетельствует о том, что степень окисления селена равна +2. Так как на четвертом уровне есть вакантные орбитали 4d-подуровня, то для атома селена характерно наличие возбужденного состояния:
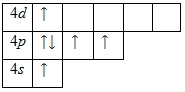
Именно поэтому для селена также характерна степень окисления +4.
Примеры решения задач
| Задание | Напишите электронную формулу иона брома в бромоводородной кислоте. В ответе укажите общее число электронов в ионе. |
| Ответ | Бромоводородная кислота имеет брутто-формулу HBr. Для того, чтобы определить в форме какого иона бром находится в кислоте, запишем уравнение её диссоциации:
HBr ↔ H+ + Br—. Запишем электронную конфигурацию бромид-иона: 35Br— 1s22s22p63s23p63d104s24p6. Т.к. ион брома отрицательно заряжен, он принимает один электрон от атома водорода, следовательно, общее количество электронов в атоме брома становится равным 36. |
| Задание | Определите элемент IV периода, который с кислородом образует оксид ЭО3, а с водородом не дает летучих соединений. В ответе укажите количество электронов в электронной оболочке атомов. |
| Ответ | Кислород в оксидах всегда проявляет валентность, равную II. Учитывая, что формула высшего оксида искомого элемента имеет вид ЭО3, его высшая валентность равна VI. Это значит, что элемент находится в IV периода и VI группе. Под эту категорию походят два элемента: хром (Cr) и селен (Se). Из них не образует соединений с водородом хром. Порядковый номер этого элемента равен 24, следовательно, в электронной оболочке его атома присутствует 24 электрона. |











