Формула пропионовой кислоты
Определение и формула пропионовой кислоты
В обычных условиях представляет собой бесцветную едкую жидкость с резким запахом. Самовоспламеняется при температуре 440oC. Смешивается с водой и органическими растворителями.
Химическая формула пропионовой кислоты
Химическая формула пропионовой кислоты может записываться двояко: C2H5COOH или C3H6O2. Она показывает, что в состав данной молекулы входят три атома углерода (Ar = 12 а.е.м.), шесть атомов водорода (Ar= 1 а.е.м.) и два атома кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу пропионовой кислоты:
Mr(C3H6O2) = 3×Ar(C) + 6×Ar(H) + 2×Ar(O);
Mr(C3H6O2) = 3×12 + 6×1 + 2×16 = 36 + 6 + 32 = 74.
Структурная (графическая) формула пропионовой кислоты
Структурная (графическая) формула пропионовой кислоты является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы (рис. 1).
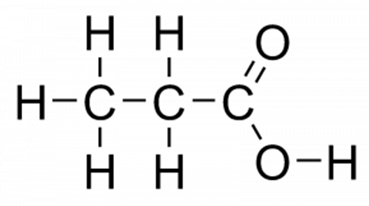
Рис. 1. Пропионовая кислота. Графическая формула.
Примеры решения задач
| Задание | Одноосновная карбоновая кислота содержит 26,1% углерода и 4,3% водорода. На основании данных условия задания произведите необходимые вычисления и установите молекулярную формулу органического вещества. |
| Решение | Запишем молекулярную формулу одноосновной карбоновой кислоты в общем виде как CxHyOw.
Известно, что ω(С) — ω(H) — ω(O) = 100%. Тогда, массовая доля кислорода в составе предельной одноосновной карбоновой кислоты будет рассчитываться как: ω(O) =100% — ω(С) — ω(H); ω(O) =100% — 26,1 – 4,3 = 69,6%. Процентное содержание элементов разделим на соответствующие относительные атомные массы (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел). Таким образом мы найдем соотношения между числом атомов в молекуле соединения: x:y:w = ω(С)/Ar(С) : ω (H)/Ar(H) : ω(O)/Ar(O); x:y:w= 26,1/12 : 4,3/1 : 69,6/16; x:y:w: = 2,18 : 4,3 : 4,35 = 1: 2 : 2. Значит простейшая формула одноосновной карбоновой кислоты будет иметь вид CH2O2 или HCOOH. Это муравьиная кислота. |
| Ответ | HCOOH |
| Задание | При полном сгорании некоторого количества углеводорода образовалось 14,08 г оксида углерода (IV) и 3,6 г воды. Найдите молекулярную формулу вещества, если относительная плотность его паров по водороду равна 39. |
| Решение | Составим схему реакции сгорания аминокислоты обозначив количество атомов углерода, водорода, кислорода и азота за «x», «у», «z» и «k» соответственно:
CxHy+ Oz→CO2 + H2O. Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м. m(C) = n(C)×M(C) = n(CO2)×M(C) = [m(CO2) / M(CO2)]×M(C); m(H) = n(H)×M(H) = 2×n(H2O)×M(H) = [2×m(H2O) / M(H2O)]×M(H); Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль; M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль. Тогда, m(C) = [14,8 / 44]×12 = 4,04 г; m(H) = 2×3,6 / 18 ×1= 0,4 г. Определим химическую формулу углеводорода: x:y = m(C)/Ar(C) : m(H)/Ar(H); x:y= 4,04/12 :0,4/1 x:y= 0,34 : 0,4 = 1 : 1. Значит его простейшая формула CH, а молярная масса 13 г/моль [M(CH) = Ar(C) + Ar(H) = 12 + 1 =13 / моль]. Значение молярной массы органического вещества можно определить при помощи его плотности по водороду: Msubstance = M(H2) × D(H2); Msubstance = 2 × 39 = 78 г/моль. Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс: Msubstance / M(CH) = 78 / 13 = 6. Значит индексы атомов углерода и водорода должны быть в 6 раз выше, т.е. формула вещества будет иметь вид C6H6.Это бензол. |
| Ответ | C6H6 |











