Какие электроны атомов азота и фосфора участвуют
Подскажите, какие электроны атомов азота и фосфора участвуют в образовании химических связей с другими элементами? Как распределяются электроны по орбиталям? Какие принципы для этого используют?
Любой химический элемент и фосфор с азотом в том числе используют для образования химических связей с другими элементами только электроны, расположенные на внешней оболочке, получившие название валентных (какие электроны атомов азота и фосфора участвуют).
Рассмотрим, как распределяются электроны в атоме по орбиталям, т. е. электронную конфигурацию многоэлектронных атомов в основном (невозбужденном) состоянии. Для построения электронной конфигурации атома воспользуемся следующими принципами заполнения орбиталей электронами:
- Принцип наименьшей энергии: в многоэлектронном атоме стабильной является такая конфигурация, для которой достигается минимум полной энергии. В первую очередь заполняются орбитали с наименьшей энергией. Энергия орбиталей увеличивается в порядке возрастания суммы квантовых чисел (n + l), а при одинаковой сумме этих чисел — в порядке возрастания главного квантового числа (правила Клечковского).
- Принцип Паули: в атоме не существует двух электронов, состояние которых описывается одинаковым набором квантовых чисел (
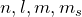 ). Следовательно, на одной орбитали (она характеризуется тремя квантовыми числами:
). Следовательно, на одной орбитали (она характеризуется тремя квантовыми числами: 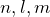 ) может находиться не более двух электронов с разными значениями спинового квантового числа (+1/2 и -1/2).
) может находиться не более двух электронов с разными значениями спинового квантового числа (+1/2 и -1/2). - Правило Хунда: в пределах одного подуровня (т. е. на орбиталях с одним и тем же значением l) электроны распределяются так, чтобы суммарный спин (
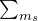 ) был максимален. Это значит, что сначала на каждой располагается по одному электрону. Лишь после того, как все орбитали будут заняты наполовину, на них может появиться второй электрон. Это правило является частным случаем принципа наименьшей энергии. Орбитали с одинаковым значением / имеют одну и ту же энергию (вырожденные орбитали), а для спаривания электронов требуется дополнительная энергия (энергия спаривания).
) был максимален. Это значит, что сначала на каждой располагается по одному электрону. Лишь после того, как все орбитали будут заняты наполовину, на них может появиться второй электрон. Это правило является частным случаем принципа наименьшей энергии. Орбитали с одинаковым значением / имеют одну и ту же энергию (вырожденные орбитали), а для спаривания электронов требуется дополнительная энергия (энергия спаривания).










