Азот и его характеристики
Общая характеристика азота
Большая часть азота находится в свободном состоянии. Свободный азот является главной составной частью воздуха, который содержит 78,2% (об.) азота. Неорганические соединения азота не встречаются в природе в больших количествах, если не считать натриевую селитру NaNO3, образующую мощные пласты на побережье Тихого океана в Чили. Почва содержит незначительные количества азота, преимущественно в виде солей азотной кислоты. Но в виде сложных органических соединений – белков – азот входит в состав всех живых организмов.
Общее содержание азота в земной коре (включая гидросферу и атмосферу) составляет 0,04% (масс.).
В виде простого вещества азот – это бесцветный газ, не имеющий запаха и весьма мало растворимый в воде. Он немного легче воздуха: масса 1 л азота равна 1,25 г.
Атомная и молекулярная масса азота
Относительной атомной массой элемента называют отношение массы атома данного элемента к 1/12 массы атома углерода. Относительная атомная масса безразмерна и обозначается Ar (индекс «r» — начальная буква английского слова relative, что в переводе означает «относительный»). Относительная атомная масса атомарного азота равна 14,0064 а.е.м.
Массы молекул, также как массы атомов выражаются в атомных единицах массы. Молекулярной массой вещества называется масса молекулы, выраженная в атомных единицах массы. Относительной молекулярной массой вещества называют отношение массы молекулы данного вещества к 1/12 массы атома углерода, масса которого равна 12 а.е.м. Известно, что молекула азота двухатомна – N2. Относительная молекулярная масса молекулы азота будет равна:
Mr(N2) = 14,0064× 2 ≈ 28.
Изотопы азота
В природе азот существует в виде двух стабильных изотопов 14N (99,635%) и 15N (0,365%). Их массовые числа равны 14 и 15 соответственно. Ядро атома изотопа азота 14N содержит семь протонов и семь нейтронов, а изотопа 15N – такое же количество протонов и шесть нейтронов.
Существует четырнадцать искусственных изотопов азота с массовыми числами от 10-ти до 13-ти и от 16-ти до 25-ти, из которых наиболее стабильным является изотоп 13Nс периодом полураспада равным 10 минут.
Ионы азота
На внешнем энергетическом уровне атома азота имеется пять электронов, которые являются валентными:
1s22s22p3.
Схема строения атома азота представлена ниже:
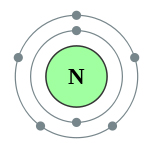
В результате химического взаимодействия азот может терять свои валентные электроны, т.е. являться их донором, и превращаться в положительно заряженные ионы или принимать электроны другого атома, т.е. являться их акцептором, и превращаться в отрицательно заряженные ионы:
N0 –5e → N2+;
N0-4e → N4+;
N0-3e → N3+;
N0-2e → N2+;
N0-1e → N1+;
N0+1e → N1-;
N0+2e → N2-;
N0+3e → N3-.
Молекула и атом азота
Молекула азота состоит из двух атомов – N2. Приведем некоторые свойства, характеризующие атом и молекулу азота:
|
Энергия ионизации атома, эВ |
14,53 |
|
Сродство атома к электрону, эВ |
0,27 |
|
Относительная электроотрицательность |
3,07 |
|
Радиус атома, нм |
0,071 |
|
Стандартная энтальпия диссоциации молекул при 25oС, кДж/моль |
945 |
Примеры решения задач
| Задание | Для образования хлорида аммония было взято 11,2 л (н.у.) газообразного аммиака и 11,4 л (н.у.) хлороводорода. Какова масса образовавшегося продукта реакции? |
| Решение | Запишем уравнение реакции получения хлорида аммония из аммиака и хлороводорода:
NH3 + HCl = NH4Cl. Найдем количество молей исходных веществ: n = V / Vm; n(NH3) = V(NH3) / Vm; n(NH3) = 11,2 / 22,4 = 0,5 моль. n(HCl) = V(NH3) / Vm; n(HCl) = 11,4 / 22,4 = 0,51 моль. n(NH3) <n(HCl), значит хлороводород в избытке и расчет ведем по аммиаку. Согласно уравнению реакции (NH3) :n(NH4Cl) = 1:1, значит n(NH4Cl) = n(NH3) = 0,5 моль. Тогда, масса хлорида аммония будет равна: M(NH4Cl) = Ar(N) + 4×Ar(H) + Ar(Cl); M(NH4Cl) = 14 + 4×1 + 35,5 = 53,5г/моль. m(NH4Cl) = n(NH4Cl) × M(NH4Cl); m(NH4Cl) = 0,5×53,5 = 26,75 г. |
| Ответ | 26,75 г |
| Задание | 10,7 г хлорида аммония смешали с 6 г гидроксида кальция и смесь нагрели. Какой газ и сколько его по массе и объему выделилось (н.у.)? |
| Решение | Запишем уравнение реакции взаимодействия хлорида аммония с гидроксидом кальция:
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O. Определим, какое из двух реагирующих веществ находится в избытке. Для этого рассчитаем их количество молей: M(NH4Cl) = Ar(N) + 4×Ar(H) + Ar(Cl); M(NH4Cl) = 14 + 4×1 + 35,5 = 53,5 г/моль. n(NH4Cl) = m (NH4Cl) / M(NH4Cl); n(NH4Cl) = 10,7 / 53,5 = 0,1 моль. M(Ca(OH)2) = Ar(Ca) + 2×Ar(H) + 2×Ar(O); M(Ca(OH)2) = 40 + 2×1 + 2×16 = 42 + 32 = 74 г/моль. n(Ca(OH)2) = m (Ca(OH)2) / M(Ca(OH)2); n(Ca(OH)2) = 6 / 74 = 0,08 моль. n(Ca(OH)2) <n(NH4Cl), значит хлорид аммония в избытке и расчет ведем по гидроксиду кальция. Согласно уравнению реакции (Ca(OH)2) :n(NH3) = 1:2, значит n(NH3) = 2×n(Ca(OH)2) = 2×0,08 = 0,16 моль. Тогда, масса аммиака будет равна: M(NH3) = Ar(N) + 3×Ar(H) = 14 + 3×1 = 17 г/моль. m(NH3) = n(NH3) ×M(NH3) = 0,16 × 17 = 2,72 г. Объем аммиака равен: V(NH3) = n(NH3) ×Vm; V(NH3) = 0,16× 22,4 = 3,584 л. |
| Ответ | В результате реакции образовался аммиак объемом 3,584 л и массой 2,72 г. |











