Закон Джоуля
Внутренняя энергия тела (системы) (![]() ) — это один из важнейших параметров, которые характеризуют систему в термодинамике. Она является функцией состояния. В соответствии с молекулярно — кинетической теорией внутренняя энергия тела складывается из кинетической и потенциальной энергии атомов и молекул, составляющих тело (тела). Так, в идеальном газе его внутренняя энергия есть суммарная кинетическая энергия всех его молекул (атомов).
) — это один из важнейших параметров, которые характеризуют систему в термодинамике. Она является функцией состояния. В соответствии с молекулярно — кинетической теорией внутренняя энергия тела складывается из кинетической и потенциальной энергии атомов и молекул, составляющих тело (тела). Так, в идеальном газе его внутренняя энергия есть суммарная кинетическая энергия всех его молекул (атомов).
Свой закон относительно внутренней энергии идеального газа Джоуль установил в 1845 г.
Формулировка закона Джоуля
Внутренняя энергия идеального газа не зависит от объема и является функцией его температуры.
Закон Джоуля — следствие второго начала термодинамики
Данный закон установлен эмпирически и является следствие второго начала термодинамики. Для обратимого процесса (в идеальном газе термодинамические процессы обратимы) выполняется равенство Клаузиуса, следовательно,запишем первое начало термодинамики, и получим:
![]()
Зная, что:
![]()
Преобразуем выражение (1) к виду:
![]()
Для идеального газа справедливо уравнение Менделеева — Клайперона:
![]()
Из выражения (4) получаем:
![]()
Подставим (5) в (3) имеем:
![]()
В математическом виде закон Джоуля можно представить выражением:
![]()
На основании молекулярно — кинетической теории внутренняя энергия идеального газа может быть вычислено в соответствии с формулой:
![]()
где ![]() — число степеней свободы молекулы газа;
— число степеней свободы молекулы газа; ![]() — универсальная газовая постоянная;
— универсальная газовая постоянная; ![]() — масса газа,
— масса газа, ![]() — молярная масса газа.
— молярная масса газа.
Как выполняется закон Джоуля, оценивают при помощи эффекта Джоуля — Томпсона. У идеального газа данный эффект не наблюдают.
Примеры решения задач
| Задание | Углекислый газ массы 44 г нагрели на 10К в условиях свободного расширения. Каково изменение внутренней энергии газа, если его считать идеальным? |
| Решение | Для идеального газа изменение внутренней энергии не зависит от изменения его объема, а зависит от температуры, следовательно, можно для решения задачи использовать формулу:
где Проведем вычисления: |
| Ответ |
| Задание | В идеальном газе неизменной массы проводят два процесса, которые изображены на рис.1. Определите, в каком процессе внутренняя энергия газа изменяется больше?
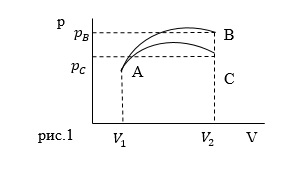
|
| Решение | Внутренняя энергия является функцией состояния, следовательно, от вида процесса ее изменение не зависит.Кроме того:
Начальные состояния газа одинаковы (точка A), значит надо сравнивать только конечные состояния (точки Bи C). По закону Джоуля внутренняя энергия идеального газа зависит от температуры и не зависит от объема газа, следовательно, достаточно определить какая температура выше (для точки В или точки С рис.1). Рассмотрим изохорный процесс, который можно было бы провести с данной массой идеального газа при объеме Из графиков имеем, что |
| Ответ | В процессе АС изменение внутренней энергии меньше, чем в процессе AB. |











