Сера и её характеристики
Общая характеристика серы
Сера встречается в природе как в свободном состоянии (самородная сера), так и в различных соединениях. Очень распространены соединения серы с различными металлами. Многие из них являются ценными рудами (например, свинцовый блеск PbS, цинковая обманка ZnS, медный блеск Cu2S) и служат источником получения цветных металлов.
Из соединений серы в природе также распространены сульфаты, главным образом, кальция и магния, Наконец, соединения серы содержатся в организмах растений и животных.
Общее содержание серы земной коре составляет приблизительно 0,1%.
Атомная и молекулярная масса серы
Относительной молекулярная масса вещества (Mr) – это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (Ar) – во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.
Значения атомной и молекулярной масс серы совпадают; они равны 32,059.
Аллотропия и аллотропные модификации серы
Сера существует в виде двух аллотропных модификаций – ромбической и моноклинной.
При обычных давлениях сера образует хрупкие кристаллы желтого цвета, плавящиеся при 112,8oС; плотность равна 2,07 г/см 3. Она нерастворима в воде, но довольно хорошо растворима в сероуглероде, бензоле и некоторых других жидкостях. При испарении этих жидкостей сера выделяется из раствора в виде желтых кристаллов ромбической системы, имеющих форму октаэдров, у которых обычно часть углов или ребер как бы срезана (рис.1). Эта модификация серы называется ромбической.
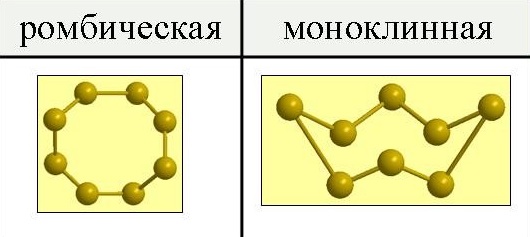
Рис. 1. Аллотропные модификации серы.
Иной формы кристаллы получаются, если медленно охлаждать расплавленную серу и, когда она частично затвердевает, слить еще не успевшую застыть жидкость. При этих условиях стенки сосуда оказываются покрыты изнутри длинными темно-желтыми игольчатыми кристаллами моноклинной системы. Эта модификация серы называется моноклинной. Она имеет плотность 1,96 г/см 3, плавится при 119,3oС и устойчива только при температуре выше 96oС.
Изотопы серы
Известно, что в природе сера может находиться в виде четырех стабильных изотопов 32S, 33S, 34S и 36S. Их массовые числа равны 32, 33, 34 и 36 соответственно. Ядро атома изотопа серы 32S содержит шестнадцать протонов и шестнадцать нейтронов, а изотопов 33S, 34S и 36S– такое же количество протонов, семнадцать, восемнадцать и двадцать нейтронов соответственно.
Существуют искусственные изотопы серы с массовыми числами от 26-ти до 49-ти, среди которых наиболее стабильным является 35S с периодом полураспада равным 87 суток.
Ионы серы
На внешнем энергетическом уровне атома серы имеется шесть электронов, которые являются валентными:
1s22s22p63s23p4.
В результате химического взаимодействия сера может терять свои валентные электроны, т.е. являться их донором, и превращаться в положительно заряженные ионы или принимать электроны другого атома, т.е. являться их акцептором, и превращаться в отрицательно заряженные ионы:
S0 –6e → S6+;
S0 -4e → S4+;
S0 -4e → S2+;
So +2e → S2-.
Молекула и атом серы
Молекула серы одноатомна — S. Приведем некоторые свойства, характеризующие атом и молекулу серы:
|
Энергия ионизации атома, эВ |
10,35 |
|
Относительная электроотрицательность |
2,56 |
|
Радиус атома, нм |
0,127 |
Примеры решения задач
| Задание | Какая масса серы потребуется для получения сульфида алюминия Al2S3 массой 30 г? В каких условиях может быть получен этот сульфид из простых веществ? |
| Решение | Запишем уравнение реакции получения сульфида серы:
2Al + 3S = Al2S3. Вычислим количество вещества сульфида алюминия (молярная масса – 150 г/моль): n = m / M; n(Al2S3) = m(Al2S3) / M(Al2S3); n(Al2S3) = 30 / 150 = 0,2 моль. Согласно уравнению реакции n(Al2S3) : n(S) = 1:3, значит: n(S) = 3 × n(Al2S3); n(S) = 3 × 0,2 = 0,6 моль. Тогда масса серы будет равна (молярная масса – 32 г/моль): m = n × M; m(S) = n(S) × M(S); m(S) = 0,6 × 32 = 19,2 г. |
| Ответ | Масса серы 19,2 г |
| Задание | При сжигании серы в кислороде получен оксид серы (IV) объемом при нормальных условиях 5,6 л. Определите массу серы, которая была сожжена. |
| Решение | Запишем уравнение реакции получения оксида серы (IV):
6S + 3O2 = 2SO3. Рассчитаем количество вещества оксида серы (IV): n = V / Vm; n(SO3) = V (SO3) / Vm; n (SO3) = 5,6 / 22,4 = 0,25 моль. Согласно уравнению реакции n(SO3) : n(S) = 2:6, значит: n(S) = 3 × n(SO3); n(S) = 3 × 0,25 = 0,75 моль. Тогда масса серы будет равна (молярная масса – 32г/моль): m = n × M; m(S) = n(S) × M(S); m(S) = 0,75 × 32 = 24г. |
| Ответ | Масса серы равна 24 г |











