Гелий и его характеристики
Общая характеристика гелия
Гелий встречается на Земле в основном в атмосфере, однако некоторые его количества выделяются в определенных местах из недр Земли вместе с природными газами. Воды многих минеральных источников тоже выделяют гелий.
Хотя содержание гелия в воздухе невелико, во Вселенной он занимает второе место по распространенности (после водорода). Спектральный анализ показывает присутствие этого элемента во всех звездах.
Гелий представляет собой бесцветный, трудносжижаемый газ (температура кипения -268,9oС), затвердевающий только под избыточным давлением (схема строения атома представлена на рис. 1). Обладает сильной способностью проникать через стекло и металлическую фольгу. Плохо растворяется в воде, лучше – в бензоле, этаноле, толуоле.
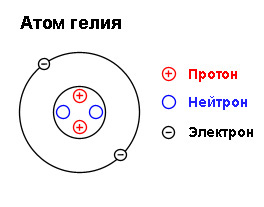
Рис. 1. Строение атома гелия.
Атомная и молекулярная масса гелия
Поскольку в свободном состоянии гелий существует в виде одноатомных молекул He, значения его атомной и молекулярной масс совпадают. Они равны 4,003.
Изотопы гелия
Гелий – наиболее распространенный после водорода элемент космоса – состоит из двух стабильных изотопов: 4He и 3He. Их массовые числа равны 4 и 3. Ядро атома гелия 4He содержит два протона и два нейтрона, а атома 3He – такое же число протонов и один нейтрон.
Спектральный анализ показывает присутствие его в атмосфере Солнца, звезд, в метеоритах. Накапливание ядер 4He во Вселенной обусловлено термоядерной реакцией, служащей источником солнечной и звездной энергии.
Ионы гелия
В обычных условиях гелий химически инертен, но при сильном возбуждении атомов он может образовывать молекулярные ионы He2+[ss2ss*1]. В обычных условиях эти ионы неустойчивы; захватывая недостающий электрон, они распадаются на два нейтральных атома.
Молекула и атом гелия
В свободном состоянии гелий существует в виде одноатомных молекул He.
Примеры решения задач
| Задание | Углеводород содержит 92,3 % углерода (с). Выведите молекулярную (эмпирическую) формулу углеводорода (СхНу), если плотность его паров по гелию (Не) равна 6,5. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле:
ω (Х) = n × Ar (X) / M (HX) × 100%. Обозначим число атомов углерода в молекуле через «х», число атомов водорода через «у». Найдем процентное содержание водорода в составе углеводорода: ω (Н) = 100% — ω (С) =100% — 92,3% = 7,7%. Найдем соответствующие относительные атомные массы элементов углерода и водорода (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел). Ar(С) = 12 а.е.м.; Ar(Н) = 1 а.е.м. Процентное содержание элементов разделим на соответствующие относительные атомные массы. Таким образом мы найдем соотношения между числом атомов в молекуле соединения: x:y = m(Сa)/Ar(С) : m(Н)/Ar(Р); x:y = 92,3/12 : 7,7/1; x:y:z = 7,7 : 7,7 = 1: 1. Значит простейшая формула углеводорода СН. M(CH) = Ar(C) + Ar(H) = 12 + 1 =13 / моль. Значение молярной массы органического вещества можно определить при помощи его плотности по гелию: Msubstance = M(Не) × D(Не); Msubstance = 4 × 6,5 = 26 г/моль. Чтобы найти истинную формулу углеводорода найдем отношение полученных молярных масс: Msubstance / M(CH) = 26 / 13 = 2. Значит индексы атомов углерода и водорода должны быть в 2 раза выше, т.е. молекулярная (эмпирическая) формула углеводорода имеет вид C2H2.Это ацетилен. |
| Ответ | C2H2.Это ацетилен. |
| Задание | В баллоне вместимостью 60 л при 20oС и 40 атм находится гелий. Определите объем израсходованного гелия при н.у., если после 8 часов работы давление в баллоне понизилось до 32 атм, а температура возросла до 22oС. |
| Решение | Сначала переведем градусы в Кельвины:
T1 = 273 + 20 = 293 К; T2 = 273 + 22 = 295 К. По объединенному газовому закону: PV / T = P0V0 / T0; V0 = PVT0 / P0T. Для исходного состояния гелия в баллоне приведенный объем составил: V0initial = P1×V1×T0 / P0×T1. Для конечного состояния гелия в баллоне приведенный объем составил: V0final = P2×V2×T0 / P0×T2. Выразим объем израсходованного гелия при н.у.: Vx = V0initial — V0final; Vx = [P1×V1×T0 / P0×T1] – [P2×V2×T0 / P0×T2]; Vx = (T0 / P0) × [(P1×V1/ T1) – (P2×V2/ T2)]. Так как вместимость баллона постоянна, то V1 = V2 = V, тогда: Vx = (T0×V / P0) × [(P1 / T1) – (P2 / T2)]; Vx = (273× 60 / 1) × [(40 / 293) – (32 / 295)] = 459 л. |
| Ответ | 459 л. |











