Валентность железа
Общие сведения о валентности железа
В виде простого вещества железо – серебристо-белый металл. Плотность равна 7,87 г/см3. Температура плавления 1539oС, кипения 3200oС. Железо имеет несколько модификаций. До 769oС устойчиво α-железо с объемно центрированной кубической решеткой и ферромагнитными свойствами. При 769oС осуществляется переход в β-железо (кристаллическая структура та же, парамагнетик). При 910oС образуется γ-железо с гранецентрированной кристаллической решеткой. Парамагнитные свойства. При 1400oС и до температуры плавления – δ- железо с объемно центрированной кубической решеткой.
Валентность железа в соединениях
Железо – двадцать шестой по счету элемент Периодической таблицы Д.И. Менделеева. Оно находится в четвертом периоде в VIIIВ группе. В ядре атома железа содержится 26 протонов и 30 нейтронов (массовое число равно 56). В атоме железа есть четыре энергетических уровня, на которых находятся 26 электронов (рис. 1).
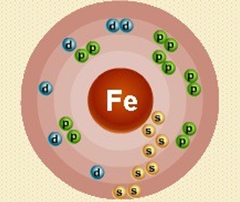
Рис. 1. Строение атома железа.
Электронная формула атома железа в основном состоянии имеет следующий вид:
1s22s22p63s23p63d64s2.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
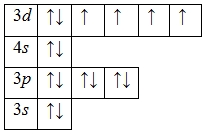
Железо проявляет в своих соединениях валентности II (FeO, Fe(OH)2, FeCl2, FeBr2) и III (Fe2O3, Fe(OH)3, FeCl3, Fe2S3).
Примеры решения задач
| Задание | Железная окалина Fe3O4массой 10 г была сначала обработана 150 мл соляной кислоты (плотность 1,1 г/мл) с массовой долей хлороводорода 20%, а затем в полученный раствор добавили избыток железа. Определите состав раствора (в % по массе). |
| Решение | Запишем уравнения реакций, которые протекают согласно условию задачи:
8HCl + Fe3O4 = FeCl2 + 2FeCl3 + 4H2O (1); 2FeCl3 + Fe = 3FeCl2 (2). Определим количество вещества хлороводорода (молярная масса равна 36,5 г/моль): msolution (HCl) = Vsolution (HCl) × ρ; msolution (HCl) = 150 × 1,1 = 165 г. ω = msolute / msolution × 100%. msolute = ω / 100% ×msolution; msolute (HCl) = ω (HCl) / 100% ×msolution (HCl); msolute (HCl) = 20 / 100% × 165 = 33г. n = m / M; n(HCl) = msolute (HCl) / M (HCl); n (HCl) = 33 / 36,5 = 0,904 моль. Рассчитаем количество вещества Fe3O4(молярная масса равна 232 г/моль) и вещество, находящееся в избытке: n(Fe3O4) = m (Fe3O4) / M (Fe3O4); n (Fe3O4) = 10 / 232 = 0,043 моль. n (Fe3O4) : n (HCl) = 1 : 8; n (HCl) = 8 × n (Fe3O4); n (HCl) = 8 × 0,043 = 0,344 моль. По условию, количество вещества хлороводорода равно 0,904 моль. Следовательно, HCl находится в избытке и будет протекать ещё одна реакция: Fe + 2HCl = FeCl2 + H2↑ (3). Определяем количество моль FeCl2 и FeCl3, образовавшихся в ходе реакции (1) и количество вещества HCl, прореагировавшее с Fe3O4: n1 (FeCl2) :n (Fe3O4) = 1:1, значит n1 (FeCl2) = n (Fe3O4) =0,043 моль; n1 (FeCl3) :n (Fe3O4) = 2:1, значит n1 (FeCl3) = 2 ×n (Fe3O4) =0,086 моль; n1 (HCl) :n (Fe3O4) = 8:1, значит n1 (HCl) = 8 ×n (Fe3O4) =0,344 моль. Рассчитаем количество вещества HCl, которое не прореагировало в реакции (1), и количество моль FeCl2, образовавшееся в ходе реакции (3): nremaining (HCl) = n (HCl) — n1 (HCl); nremaining (HCl) = 0,904 — 0,344 = 0,53 моль; n3 (FeCl2) :nremaining (HCl) = 1:2, значит n3 (FeCl2) = 1/2× nremaining (HCl) =0,28 моль. Определяем количество вещества FeCl2, образовавшееся во второй реакции, общее количество моль и массу FeCl2 (молярная масса равна 127 г/моль): n2 (FeCl2) = n1 (FeCl3) = 00,086 моль; n2 (FeCl2) :n2 (FeCl3) = 3:2, значит n2 (FeCl2) = 3/2× n2 (FeCl3) =0,129 моль; nsum (FeCl2) = 0,043 + 0,129 + 0,28 = 0,452 моль; m = n×M; m(FeCl2)= nsum (FeCl2)×M (FeCl2); m (FeCl2)= 0,452 × 127 = 57,404 г. Определяем количество моль и массу железа (молярная масса равна 56 г/моль) железа, вступившего в реакции (2) и (3): n2 (Fe) :n2 (FeCl3) = 1:2, значит n2 (Fe)= 1/2× n2 (FeCl3) = 0,043 моль; n3 (Fe) :nremaining (HCl) = 1:2, значит n2 (Fe)= 1/2× nremaining (HCl) = 0,28 моль; nsum (Fe) = 0,043 + 0,28 = 0,323 моль; m(FeCl2)= nsum (Fe)×M (Fe); m (Fe)= 0,28 × 56 = 18,088 г. Вычислим количество моль и массу водорода (молярная масса равна 2г/моль), выделившегося в реакции (3): n3 (H2) = 1/2× nremaining (HCl) = 0,28моль; m (H2)= n (H2)×M (H2); m (H2)= 0,28 × 2 = 0,56 г. Определим массу полученного раствора и массовую долю хлорида железа (II) в нем: m’solution = msolution (HCl) + m(Fe3O4) + msum(Fe) – m(H2); m’solution = 165 + 10 + 18,088 – 0,56 = 192,528 г; ω(FeCl2)=msum(FeCl2) / msolution × 100%; ω (FeCl2)=57,404 / 192,528 × 100% = 29,82%. |
| Ответ | Массовая доля хлорида железа (II) равна 29,82%. |











