Валентность углерода
Общие сведения о валентности углерода
В свободном состоянии углерод известен в виде алмаза, кристаллизующегося в кубической и гексагональной (лонсдейлит) системе, и графита, принадлежащего к гексагональной системе. Такие формы углерода, как древесный уголь, кокс или сажа имеют неупорядоченную структуру. Также есть аллотропные модификации, полученные синтетическим путем – это карбин и поликумулен – разновидности углерода, построенные из линейных цепных полимеров типа …-C≡ C-C≡C-… или .. = C = C = C = C = ….
Известны также аллотропные модификации углерода, имеющие следующие названия: графен, фуллерен, нанотрубки, нановолокна, астрален, стеклоуглерож, колоссальные нанотрубки; аморфный углерод, углеродные нанопочки и углеродная нанопена.
В природе углерод находится в виде двух стабильных изотопов 12С (98,892%) и 13С (1,108%).
Валентность углерода в соединениях
Углерод — шестой по счету элемент Периодической таблицы Д.И. Менделеева. Он находится во втором периоде во IVA группе. В ядре атома углерода содержится 6 протонов и 6 нейтронов (массовое число равно 12). В атоме углерода есть два энергетических уровня, на которых находятся 6 электронов (рис. 1).
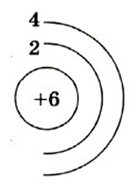
Рис. 1. Строения атома углерода.
Электронная формула атома углерода в основном состоянии имеет следующий вид:
1s22s22p2.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
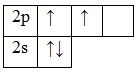
Наличие двух неспаренных электронов свидетельствует о том, что углерод проявляет валентность II в своих соединения (CIIO).
В атоме углерода есть 1 вакантная орбиталь 2p-подуровня. За счет её наличия электроны 2s-подуровня могут распариваться и один из них совершает переход и занимает свободную 2p-орбиталь, т.е. для углерода характерно возбужденное состояние.
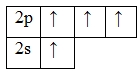
Наличие четырех неспаренных электронов свидетельствует о том, что углерод в своих соединениях (CIVO2, CIVH4, H2CIVO3 и др.) проявляет валентность равную IV.
Примеры решения задач
| Задание | Степень окисления +2, а валентность IV атом углерода имеет в соединении: 1) CO; 2) CO2; 3) HCOOH; 4) CH2Cl2. |
| Решение | Определение валентности углерода следует начинать, указывая валентности для тех элементов, для которых они известны и имеют постоянное значение. Не стоит забывать и про индексы, показывающие количество атомов определенного элемента в составе данного соединения.
Что касается определения степени окисления, нужно руководствоваться теми же правилами, но и помнить, что степень окисления указывается со знаком «+» или «-», а молекула вещества электронейтральна.
|
| Ответ | Вариант ответа 3. |
| Задание | Не проявляет высшей валентности, равной номеру группы, элемент: 1) углерод; 2) хлор; 3) фосфор; 4) фтор. |
| Решение | Как сказано в условии задачи высшая валентность химического элемента можно определить по номеру группы, в которой он находится в Периодической таблице Д.И. Менделеева. Углерод, хлор, фосфор и фтор расположены в IV, VII, V и VII группах, соответственно. Среди них, только фтор не проявляет высшей валентности, равной номеру группы. Единственная валентность характерная для фтора равна I. |
| Ответ | Вариант ответа 4. |











