Валентность скандия
Общие сведения о валентности скандия
Плотность – 3,0 г/см3. Температуры плавления и кипения равны 1541oС и 2850oС, соответственно. По химической активности скандий уступает лишь щелочным и щелочно-земельным металлам. Вследствие пассивирования скандий не растворяется в воде и с ней не взаимодействует.
Валентность скандия в соединениях
Скандий находится в четвертом периоде в IIIB группе Периодической таблицы Д.И. Менделеева. Порядковый номер равен 21. В ядре атома скандия содержится 21 протон и 24 нейтрона (массовое число равно 45). В атоме скандия есть четыре энергетических уровня, на которых находятся 21 электрон (рис. 1).
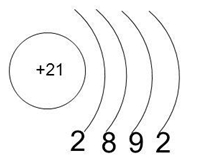
Рис. 1. Строения атома скандия.
Электронная формула атома скандия в основном состоянии имеет следующий вид:
1s22s22p63s23p63d14s2.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
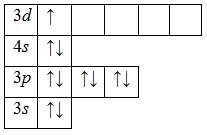
Атом скандия способен переходить в возбужденное состояние: электроны 4s-подуровня распариваются и один из них занимает вакантную орбиталь 3d-подуровня:
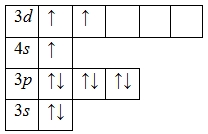
Наличие трех неспаренных электронов свидетельствует о том, что скандий проявляет валентность III в своих соединениях (ScIII2O3, ScIII(OH)3, ScIIICl3, ScIII2(SO4)3 и т.д.). Валентность скандия постоянная.
Примеры решения задач
| Задание | При действии на смесь меди и железа массой 20 г избытком соляной кислоты выделилось 5,6 л газа (н.у.). Определить массовые доли металлов в смеси. |
| Решение | Медь не реагирует с соляной кислотой, поскольку стоит в ряду активности металлов после водорода, т.е. выделение водорода происходит только в результате взаимодействия кислоты с железом.
Запишем уравнение реакции: Fe + 2HCl = FeCl2 + H2↑ Найдем количество вещества водорода: v(H2) = V(H2) / Vm = 5,6 / 22,4 = 0,25 моль Согласно уравнению реакции: v(H2) = v(Fe) = 0,25 моль Найдем массу железа: m(Fe)= v(Fe) × M(Fe) = 0,25 • 56 = 14 г. Рассчитаем массовые доли металлов в смеси: ωFe = mFe/mmixture = 14 / 20 = 0,7 = 70% ωCu = 100 – 70 = 30% |
| Ответ | 70% железа, 30% меди |
| Задание | При взаимодействии 6,0 г металла с водой выделилось 3,36 л водорода (н.у.). Определите этот металл, если он в своих соединениях двухвалентен.
Решение: Т.к. металл двухвалентен, его реакция с водой будет описываться уравнением: Ме + 2Н2О = Ме(ОН)2 + Н2↑ Согласно уравнению v(Ме) =v(Н2) = 3,36/22,4 = 0,15 моль Отсюда атомная масса металла равна: Ar(Ме) = m/v= 6,0/0,15 = 40 г/моль Следовательно, этот металл — кальций. |
| Ответ | Кальций |











