Валентность серы
Общие сведения о валентности серы
При обычном давлении сера образует хрупкие кристаллы желтого цвета, плавящиеся при температуре 112,8oС. Плотность 2,07 г/см3. Нерастворима в воде, но довольно хорошо растворима в сероуглероде, бензоле и некоторых других жидкостях. При испарении этих жидкостей сера выделяется из раствора в виде прозрачных желтых кристалликов ромбической системы, имеющих форму октаэдров (ромбическая модификация).
Если расплавленную серу медленно охлаждать и в тот момент, когда она частично затвердевает слить еще не успевшую застыть жидкость можно получить длинные темно-желтые игольчатые кристаллы моноклинной системы (моноклинная модификация). Плотность 1,96 г/см3. Температура плавления 119,3oС.
Валентность серы в соединениях
Сера — шестнадцатый по счету элемент Периодической таблицы Д.И. Менделеева. Она находится в третьем периоде в VIA группе. В ядре атома серы содержится 16 протонов и 16 нейтронов (массовое число равно 32). В атоме серы есть три энергетических уровня, на которых находятся 16 электронов (рис. 1).
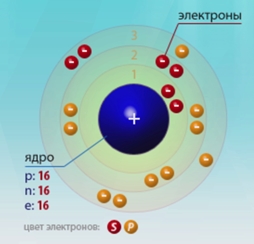
Рис. 1. Строения атома серы.
Электронная формула атома серы в основном состоянии имеет следующий вид:
1s22s22p63s23p4.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
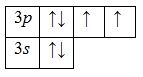
Наличие двух неспаренных электронов свидетельствует о том, что сера способна проявлять валентность II в своих соединениях (H2SII).
Для атома серы характерно наличие нескольких возбужденных состояний из-за того, что орбитали 3d-подуровня являются вакантными (на третьем энергетическом слое помимо 3s- и 3p-подуровней есть еще и 3d-подуровень). Сначала распариваются электроны 3p -подуровня и занимают свободные d-орбитали, а после – электроны 3s-подуровня:
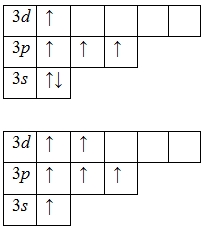
Наличие четырех и шести неспаренных электронов в возбужденном состоянии свидетельствует о том, что сера проявляет в своих соединениях валентности IV (SIVO2, H2SIVO3, Na2SIVO3) и VI (SVIO3, H2SVIO4, CaSVIO4).
Примеры решения задач
| Задание | Рассчитайте массовую долю серы в сульфите натрия (Na2SO3). |
| Решение | Массовая доля элемента в соединении рассчитывается по следующей формуле:
ω= n × Ar(Э) / Mr × 100%. Молекулярная масса сульфита натрия равна 126. Значит, массовая доля серы в нем будет равна: ω (S) = n × Ar(S) / Mr (Na2SO3) × 100%; ω (S) = 1 × 32 / 126 × 100% = 23,53%. |
| Ответ | Массовая доля серы равна 23,53%. |
| Задание | В одном из оксидов серы массовая доля кислорода составляет 50%. Определите, какой это оксид. |
| Решение | Допустим, что формула оксида серы имеет вид SxOy. Количество атомов каждого элемента в молекуле пропорционально следующему отношению:
x :y = ω (S)/Ar(S) : ω (O)/Ar(O). Массовая доля кислорода в оксиде равна: ω (O) = 100% — ω (S) = 100% — 50% = 50%. Тогда, x :y = 50/32 : 50/16; x :y = 1,56 : 3,125; x :y = 1: 2. Следовательно, формула оксида серы имеет вид SO2 – это оксид серы (IV). |
| Ответ | SO2 –оксид серы (IV). |











