Валентность селена
Общие сведения о валентности селена
В свободном состоянии селен образует несколько аллотропных видоизменений, из которых наиболее устойчивым является аморфный селен, представляющий собой красно-бурый порошок, и серый селен, образующий хрупкие кристаллы с металлическим блеском. Селен полупроводник.
Валентность селена в соединениях
Селен–тридцать четвертый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в четвертом периоде в VIA группе. В ядре атома селена содержится 34 протона и 45 нейтронов (массовое число равно 79). В атоме селена есть четыре энергетических уровня, на которых находятся 34 электрона (рис. 1).
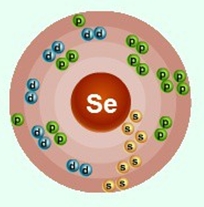
Рис. 1. Строение атома селена.
Электронная формула атома селена в основном состоянии имеет следующий вид:
1s22s22p63s23p63d104s24p4.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
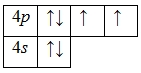
Наличие двух неспаренных электронов свидетельствует о том, что селен способен проявлять валентность II (низшая валентность) в своих соединениях (H2Se).
Для атома селена характерно наличие нескольких возбужденных состояний из-за того, что орбитали 4d-подуровня являются вакантными (на четвертом энергетическом слое помимо 4s- и 4p-подуровней есть еще и 4d-подуровень). Сначала распариваются электроны 4p -подуровня и занимают свободные d-орбитали, а после – электроны 4s-подуровня:
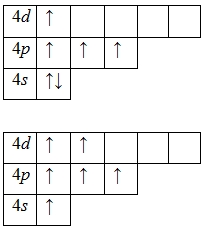
Наличие четырех и шести неспаренных электронов в возбужденном состоянии свидетельствует о том, что селен проявляет в своих соединениях валентности IV (SeO2) и VI (H2SeO4) (высшая валентность).
Примеры решения задач
| Задание | Выведите химическую формулу соединения, в состав которого входят 3,95 массовых частей химического элемента селена (Ar (Se) = 79) и 0,1 массовых частей водорода. |
| Решение | Пусть формула соединения селена с водородом имеет вид SexHy. Относительная атомная масса водорода равна 1. Составим пропорцию:
3,95 м.ч. Se – 79 г; 0,1 м.ч. H – х. Найдем х: x = 79 ×0,1 / 3,95 = 2. Это означает, что в соединении присутствует 2 атома водорода и один атом селена. Формула соединения селена с водородом имеет вид SeH2. |
| Ответ | Формула имеет вид SeH2. |
| Задание | Какую массу оксида селена (VI) следует добавить в 100 г 15%-го раствора селеновой кислоты, чтобы увеличить её массовую долю вдвое? |
| Решение | Запишем уравнение реакции:
SeO3 + H2O = H2SeO4. Найдем массу селеновой кислоты в исходном растворе: ω = msolute / msolution × 100%. msolute = ω / 100% ×msolution; msolute (H2SeO4) = ω (H2SeO4) / 100% ×msolution (H2SeO4); msolute (H2SeO4) = 15 / 100% × 100 = 15г. Пусть число моль оксида селена (VI), которое нужно добавить к раствору селеновой кислоты, чтобы увеличить её массовую долю вдвое равно х моль. Тогда масса оксида селена (VI) (молярная масса – 127 г/моль) равна: m = n × M; m (SeO3) = n (SeO3)× M (SeO3); m (SeO3)= x × 127 = 127x. Согласно уравнению реакции n (SeO3): n (H2SeO4) = 1:1, т.е. n (SeO3) = n (H2SeO4) = х моль. Тогда, масса селеновой кислоты, образовавшейся после добавления оксида селена (VI) будет равна (молярная масса – 145 г/моль): m2 (H2SeO4) = n (H2SeO4)× M (H2SeO4); m2 (H2SeO4)=x × 145 = 145x. Найдем массу нового раствора и массу селеновой кислоты в нем: m’solution (H2SeO4) = msolution (H2SeO4) + m (SeO3) = 100 + 127x; m3 (H2SeO4)=msolute (H2SeO4) + m2 (H2SeO4) = 15 + 145x. Рассчитаем массу оксида селена (VI), которую нужно добавить к раствору 15%-му селеновой кислоты, чтобы увеличить её массовую долю вдвое: ω‘ (H2SeO4) = m3 (H2SeO4) / m’solution (H2SeO4) × 100%; 0,3 = 15 + 145х/100 +127х; х = 0,14, т.е. n (SeO3) = 0,14 моль; m (SeO3)= 0,14 × 127 = 17,8 г. |
| Ответ | Масса оксида селена (VI) равна 17,8 г. |











