Валентность никеля
Общие сведения о валентности никеля
В виде простого вещества никель – блестящий белый метал с серебристым оттенком. Плотность 8,91г/см3. Температура плавления 1455oС, кипения 2900oС.
Никель имеет две аллотропные модификации. Ниже 250oС устойчив α-никель с гексагональной решеткой, выше 2500oС — β-никель с гранецентрированной кубической решеткой.
Валентность никеля в соединениях
Никель – двадцать восьмой по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в четвертом периоде в VIIIВ группе. В ядре атома никеля содержится 28 протонов и 31 нейтрон (массовое число равно 59). В атоме никеля есть четыре энергетических уровня, на которых находятся 28 электронов (рис. 1).
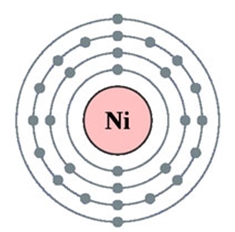
Рис. 1. Строение атома никеля.
Электронная формула атома никеля в основном состоянии имеет следующий вид:
1s22s22p63s23p63d84s2.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
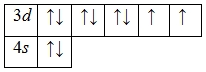
Наличие двух неспаренных электронов свидетельствует о том, что никель проявляет в своих соединениях валентность II (NiO, Ni(OH)2, NiCl2, NiBr2). Известно, что для никеля также характерна валентность III (Ni2O3, NiOOH).
Примеры решения задач
| Задание | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
NiCl2 → Ni → NiSO4→Ni(NO3)2→ Ni(OH)2→ NiCl2. Уравнения реакций, протекающих в растворах, изобразите в ионной и сокращенной ионной формах. |
| Ответ | Поместив в раствор хлорида никеля (II) более активный, чем никель металл, можно получить никель в свободном виде (реакция замещения):
NiCl2 + Zn → Ni + ZnCl2; Ni2+ + Zno → Nio + Zn2+. Никель растворяется в разбавленной серной кислоте с образованием сульфата никеля (II): Ni + H2SO4 (dilute) → NiSO4 + H2↑; Nio + 2H+ → Ni2+ ++ H2. Нитрат никеля (II) можно получить по реакции обмена: NiSO4+ Ba(NO3)2→ Ni(NO3)2 + BaSO4↓; SO42- + Ba2+ → BaSO4↓. Подействовав на нитрат никеля (II) щелочью можно получить гидроксид никеля (II): Ni(NO3)2 + 2NaOH → Ni(OH)2↓+ 2NaNO3; Ni2+ + 2OH— = Ni(OH)2↓. Хлорид никеля (II) из гидроксида никеля (II) можно получить по реакции нейтрализации с соляной кислотой: Ni(OH)2+ 2HCl → NiCl2 + 2H2O; OH— + H+ = H2O. |
| Задание | Какую массу хлорида никеля (II) можно получить при нагревании 17,7 г никеля и 12 л хлора (н.у.)? Какой объем 0,06М раствора можно приготовить из этой массы соли? |
| Решение | Запишем уравнение реакции:
Ni + Cl2 = NiCl2. Найдем количество моль никеля (молярная масса – 59 г/моль) и хлора, вступивших в реакцию используя данные указанные в условии задачи: n = m / M; n(Ni) = m (Ni) / M (Ni); n (Ni) = 17,7 / 59 = 0,3 моль. n = V / Vm; n(Cl2) = V (Cl2) / Vm; n (Cl2) = 12 / 22,4 = 0,54 моль. Согласно уравнению задачи n (Ni):n (Cl2) = 1:1. Это означает, что хлор находится в избытке и все дальнейшие расчеты следует вести по никелю. Найдем количество вещества и массу образовавшегося хлорида никеля (II) (молярная масса 130 г/моль): n (Ni): n (NiCl2) = 1:1; n (Ni) =n (NiCl2) = 0,3 моль. m = n×M; m(NiCl2)= n (NiCl2)×M (NiCl2); m (NiCl2)= 0,3 × 130 = 39 г. Рассчитаем объем 0,06 М раствора, который можно получить из 39 г хлорида никеля (II): c = n/V; V = c/n; V(NiCl2) = n (NiCl2)/ c (NiCl2); V (NiCl2)=0,3 / 0,06= 0,5 л. |
| Ответ | Масса хлорида никеля (II) равна 39 г, объем 0,06М раствора – 0,5 л (500 мл). |











