Валентность натрия
Общие сведения о валентности натрия
Натрий представляет собой серебристо-белый металл. Он настолько мягок, что легко режется ножом. Вследствие легкой окисляемости на воздухе натрий хранят под слоем керосина. Легкий – плотность равна 0,97 г/см3. Температуры плавления и кипения относительно невысоки 97,8oС и 882,9oС, соответственно.
Валентность натрия в соединениях
Натрий — одиннадцатый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в третьем периоде в IA группе. В ядре атома натрия содержится 11 протонов и 12 нейтронов (массовое число равно 23). В атоме натрия есть три энергетических уровня, на которых находятся 11 электронов (рис. 1).
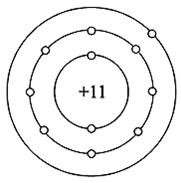
Рис. 1. Строения атома натрия.
Электронная формула атома натрия в основном состоянии имеет следующий вид:
1s22s22p63s1.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
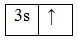
Наличие одного единственного неспаренного электрона свидетельствует о том, что натрий проявляет валентность I в своих соединения (NaI2O, NaIOH, NaICl, CH3COONaI, NaI3PO4 и т.д.). Валентность натрия постоянная.
Примеры решения задач
| Задание | Укажите все валентности, характерные для химического элемента азота. Приведите примеры соединений, в которых он их проявляет. |
| Ответ | Для азота характерны следующие валентности: I (N2O), II (NO), III (NH3, HNO2), IV (NO2) и V (N2O5, HNO3). |
| Задание | К 200-м граммам 5%-го раствора хлорида натрия добавили 15 г этой же соли и столько же граммов воды. Чему стала равна массовая доля хлорида натрия в получившемся растворе? |
| Решение | Решение задачи следует начать с записи формулы для вычисления массовой доли растворенного вещества:
ω = msolute / msolution × 100%; Найдем массу растворенного вещества хлорида натрия в изначальном растворе: msolute = ω / 100% ×msolution; msolute (NaCl) = ω (NaCl) / 100% ×msolution; msolute (NaCl) = 5 / 100% × 200 = 10 г. Рассчитаем массу нового раствора: msolution(new) = msolute + m(NaCl) + m (H2O); msolution(new) = 200 + 15 + 15 = 230 г. Найдем общую массу растворенного хлорида натрия и его массовую долю в новом растворе: m(NaCl)sum = msolute (NaCl) + m(NaCl); m(NaCl)sum = 10 + 15 = 25г. ω (NaCl)new= m(NaCl)sum / msolution(new) × 100%; ω (NaCl)new= 25 / 230 × 100% = 11%. |
| Ответ | Получится 11%-й раствор хлорида натрия. |











