Валентность лития
Общие сведения о валентности лития
В виде простого вещества литий – мягкий серебристо-белый металл (температура плавления 180,5oС, температура кипения 1336,6oС) (рис. 1). Из металлов он самый легкий (плотность 0,539 г/см3).

Рис. 1. Литий. Внешний вид.
Литий химически очень активен. С кислородом и азотом взаимодействует при обычных условиях, поэтому на воздухе тотчас окисляется, образуя темно-серый налет продуктов взаимодействия (Li2O, Li3N). При температуре выше 200oС загорается. В атмосфере фтора и хлора, а также брома и йода самовоспламеняется при обычных условиях.
Валентность лития в соединениях
Литий – третий по счету элемент Периодической таблицы Д.И. Менделеева. Он находится во втором периоде в IA группе. Ядро атома лития содержит 3 протона и нейтрона (массовое число равно 7). В атоме лития есть два энергетических уровня, на которых находятся 3 электрона (рис. 2).
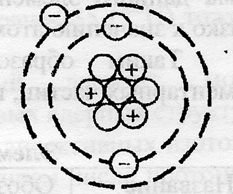
Рис. 2. Строения атома лития.
Электронная формула атома лития в основном состоянии имеет вид:
1s22s1.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):

Атом лития имеет один валентный электрон (неспаренный), что свидетельствует о том, что для лития характерна валентность равная I. Валентность лития постоянна во всех соединениях (LiIH, LiI2O, LiIOH, LiINO3, LiICl и т.д.)
Примеры решения задач
| Задание | Образец лития массой 0,5 г растворили в воде. На нейтрализацию полученного раствора израсходовали 29,2 г 1,5%-ной соляной кислоты. Какова массовая доля (%) лития в исходном образце? |
| Решение | Запишем уравнения реакций:
2Li + 2H2O = 2LiOH + H2↑ (1); LiOH + HCl = LiCl + H2O (2). Определяем массу и количество вещества соляной кислоты (молярная масса – 36,5 г/моль): ω =msolute / msolution× 100%; msolute = ω / 100% ×msolution; msolute (HCl) = ω (HCl) / 100% ×msolution; msolute (HCl) = 1.5 / 100% × 29,2 = 0,438 г; n = m / M; n (HCl) = m (HCl) / M (HCl); n (HCl) = 0,438 / 36,5 = 0,012 моль. Определяем количество вещества LiOH, прореагировавшего с HCl. Согласно уравнению (2): n (LiOH) :n (HCl) = 1:1, значит, n (LiOH) =n (HCl) = 0,012 моль. Определяем количество вещества, массу и массовую долю лития в исходном образце (массовая доля равна 7 г/моль). Согласно уравнению (1): n (Li) :n (LiOH) = 1:1; n (Li) = n (LiOH) = 0,012 моль. m = n × M; m(Li) = n (Li) × M (Li); m (Li) = 0,012 × 7 = 0,084 г; ω(Li) =msolute(Li) / msolution(new) × 100%; ω (Li) = 0,084 / 0,5 × 100% = 16,8%. |
| Ответ | Массовая доля лития равна 16,8%. |
| Задание | При электролизе раствора бромида одновалентного метала, содержащего 34,8 г этой соли, выделилось 4,48 л водорода (н.у.). Определите, бромид какого металла взяли. Считайте разложение соли полным. |
| Решение | Запишем уравнение реакции электролиза:
2MeBr + 2H2O = 2MeOH + Br2 + H2. Определим количество моль водорода, выделившегося в ходе реакции и соли, подвергшейся электролизу: n =V / Vm; n (H2) =V (H2) / Vm; n (H2) =4,48 / 22,4 = 0,2 моль; n (MeBr) : n (H2) = 2 :1, следовательно, n (MeBr) = 2 ×n (H2) = 2 ×0,2 = 0,4 моль. Определяем молярные массы соли и металла: M = m / n; M (MeBr) = m (MeBr) / n (MeBr); M (MeBr) = 34,8 / 0,4 = 87 г/моль; M (Me) = M (MeBr) — M (Br); M (Me) = 87 – 80 = 7 г/моль, Следовательно, соль – бромид лития. |
| Ответ | Соль – бромид лития. |











