Валентность кремния
Общие сведения о валентности кремния
Кремний устойчив только в алмазоподобной (кубической) модификации. Тугоплавок – температура плавления равна 1415oС и отличается высокой твердостью. Имеет темно-серый цвет и металлический вид. При комнатной температуре кремний является полупроводником. Графитоподобная модификация кремния неустойчива.
Валентность кремния в соединениях
Кремний — четырнадцатый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в третьем периоде в IVA группе. В ядре атома кремния содержится 14 протонов и 14 нейтронов (массовое число равно 28). В атоме кремния есть три энергетических уровня, на которых находятся 14 электронов (рис. 1).
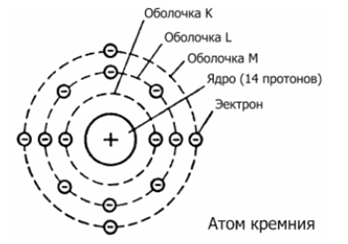
Рис. 1. Строения атома кремния.
Электронная формула атома кремния в основном состоянии имеет следующий вид:
1s22s22p63s23p2.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
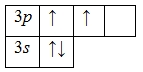
Наличие двух неспаренных электронов свидетельствует о том, что кремний способен проявлять валентность II(SiIIO).
Поскольку на третьем энергетическом слое помимо 3s-подуровня есть еще и 3p-подуровень, для атома кремния характерно наличие возбужденного состояния: пара электронов 3s-подуровня распаривается и один из них занимает вакантную орбиталь 3p-подуровня.
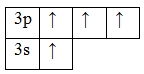
Наличие четырех неспаренных электронов свидетельствует о том, что для кремния также характерна валентность IV (встречается наиболее часто) (SiIVO2, H2SiIVO3, SiIVH4, Ca2SiIV, SiIVF4и др.).
Примеры решения задач
| Задание | Вычислите массу кремния, который может прореагировать с горячим раствором щелочи объемом 200 мл (массовая доля NaOH 35%, плотность 1,38 г/мл). Определите объем водорода, выделяющийся в результате этой реакции. |
| Решение | Запишем уравнение реакции:
Si + 2NaOH + H2O = Na2SiO3 + + 2H2↑. Найдем массу раствора гидроксида натрия, а также массу растворенного вещества гидроксида натрия в нем: msolution =Vsolution × ρ; msolution =200 × 1,38 = 276 г. ω = msolute / msolution × 100%; msolute = ω / 100% ×msolution; msolute (NaOH) = ω (NaOH) / 100% ×msolution; msolute (NaOH) = 35 / 100% × 276 = 96,6 г. Рассчитаем количество моль гидроксида натрия (молярная масса равна 40 г/моль): n = m / M; n(NaOH) = m (NaOH) / M (NaOH); n (NaOH) = 96,6 / 40 = 2,415 моль. Согласно уравнению реакции n (NaOH) :n (H2) = 1: 1. Значит, n (NaOH) = n (H2) =2,415 моль. Тогда, объем выделившегося водорода будет равен: V = n × Vm; V (H2) = n (H2) × Vm; V (H2) = 2,415 × 22,4 = 56л. Согласно уравнению реакции n (NaOH) :n (Si) =2: 1. Значит,количество вещества кремния будет равно: n (Si) = 2 × n (NaOH) = 2 × 2,415 = 4,83 моль. Тогда масса кремния, вступившего в реакцию будет равна (молярная масса – 28 г/моль): m = n × M; m(Si) = n (Si)× M (Si); m (Si) = 4,83 × 28 = 135,24 г. |
| Ответ | Масса кремния равна 135,24 г, объем водорода равен 56 л. |
| Задание | Как осуществить следующие превращения:
а) CaCO3 → CaSiO3; б) Na2SiO3 → A → SiO2. Назовите вещество А. Напишите уравнения реакций. |
| Ответ | а) Чтобы из карбоната кальция получить силикат кальция необходимо сплавить его с оксидом кремния:
CaCO3 + SiO2 → CaSiO3 + CO2↑. б) Пропустив через раствор силиката натрия углекислый газ можно получить студенистый осадок – кремниевую кислоту, прокалив которую получим искомый оксид кремния. Следовательно, вещество А – это кремниевая кислота. Уравнения реакций записываются следующим образом: Na2SiO3+ H2O + CO2→ H2SiO3↓ + Na2CO3; H2SiO3→ SiO2 + H2O. |











