Валентность и степень окисления
Валентность
Согласно обменному механизму метода валентных связей, валентность химических элементов определяется числом содержащихся в атоме неспаренных электронов. Для s- и p-элементов – это электроны внешнего уровня, для d-элементов – внешнего и предвнешнего уровней.
Значения высшей и низшей валентностей химического элемента можно определить при помощи Периодической таблицы Д.И. Менделеева. Высшая валентность элемента совпадает с номером группы, в которой он расположен, а низшая представляет собой разность между числом 8 и номером группы. Например, бром расположен в VIIA группе, значит его высшая валентность равна VII, а низшая – I.
Спаренные (расположенные по два на атомных орбиталях) электроны при возбуждении могут разъединяться при наличии свободных ячеек того же уровня (разъединение электронов в какой-либо уровень невозможно). Рассмотрим на примере элементов Iи II групп. Например, валентность элементов главной подгруппы I группы равна единице, так ка на внешнем уровне атомы этих элементов имеют один электрон:
3Li 1s22s1

Валентность элементов главной подгруппы II группы в основном (невозбужденном) состоянии равна нулю, так как на внешнем энергетическом уровне нет неспаренных электронов:
4Be 1s22s2

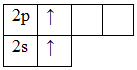
При возбуждении этих атомов спаренные s-электроны разъединяются в свободные ячейки p-подуровня этого же уровня и валентность становится равной двум (II):
Be*
Степень окисления
Для характеристики состояния элементов в соединениях введено понятие степени окисления.
Положительная степень окисления обозначает число электронов, которые смещаются от данного атома, а отрицательная – число электронов, которые смещаются к данному атому.
Из этого определения следует, что в соединениях с неполярными связями степень окисления элементов равна нулю. Примерами таких соединений могут служить молекулы, состоящие из одинаковых атомов (N2, H2, Cl2).
Степень окисления металлов в элементарном состоянии равна нулю, так как распределение электронной плотности в них равномерно.
В простых ионных соединениях степень окисления входящих в них элементов равна электрическому заряду, поскольку при образовании этих соединений происходит практически полный переход электронов от одного атома к другому: Na+1I-1, Mg+2Cl-12, Al+3F-13, Zr+4Br-14.
При определении степени окисления элементов в соединениях с полярными ковалентными связями сравнивают значениях их электроотрицательностей. Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, то последние имеют в соединениях отрицательную степень окисления.
Понятие степени окисления для большинства соединений имеет условных характер, так как не отражает реальный заряд атома. Однако это понятие весьма широко используется в химии.
Большинство элементов могут проявлять разную степень окисления в соединениях. При определении их степени окисления пользуются правилом, согласно которому сумма степеней окисления элементов в электронейтральныхмолекуах равна нулю, а в сложных ионах – заряду этих ионов. В качестве примера рассчитаем степень окисления азота в соединениях состава KNO2 и HNO3. Степень окисления водорода и щелочных металлов в соединениях равна (+), а степень окисления кислорода – (-2). Соответственно степень окисления азота равна:
KNO2 1+ x + 2 × (-2) = 0, x=+3.
HNO3 1+x+ x + 3 × (-2) = 0, x=+5.
Примеры решения задач
| Задание | Валентность IV характерна для: а)Ca; б) P; в) O; г)Si? |
| Решение | Для того, чтобы дать верный ответ на поставленный вопрос будем рассматривать каждый из предложенных вариантов в отдельности.
а) Кальций – металл. Характеризуется единственно возможным значением валентности, совпадающим с номером группы в Периодической таблице Д.И. Менделеева, в которой он расположен, т.е. валентность кальция равна II. Ответ неверный. б) Фосфор – неметалл. Относится к группе химических элементов с переменной валентностью: высшая определяется номером группы в Периодической таблице Д.И. Менделеева, в которой он расположен, т.е. равна V, а низшая –разностью между числом 8 и номером группы, т.е. равна III. Ответ неверный. в) Кислород — неметалл. Характеризуется единственно возможным значением валентности равным II. Ответ неверный. г) Кремний — неметалл. Характеризуется единственно возможным значением валентности, совпадающим с номером группы в Периодической таблице Д.И. Менделеева, в которой он расположен, т.е. валентность кремния равна IV. Это верный ответ. |
| Ответ | Вариант (г) |
| Задание | Какую валентность имеет железо в соединении, которое образуется при его взаимодействии с соляной кислотой: а)I; б) II; в) III; г) VIII? |
| Решение | Запишем уравнение взаимодействия железа с соляной кислотой:
Fe + HCl = FeCl2 + H2↑. В результате взаимодействия образуется хлорид железа и выделяется водород. Чтобы определить валентность железа по химической формуле, сначала считаем количество атомов хлора: 2 × 1 = 2. Вычисляем общее число единиц валентности хлора: 2 × 1 = 2. Определяем число атомов железа: оно равно 1. Тогда валентность железа в его хлориде будет равна: 2 / 1 = 2. |
| Ответ | Валентность железа в соединении, образовавшемся при его взаимодействии с соляной кислотой равна II. |











