Валентность гелия
Общие сведения о валентности гелия
По физическим свойствам гелий наиболее близок к молекулярному водороду. Вследствие ничтожной поляризуемости атомов гелия у него самые низкие температуры кипения (-269oС) и плавления (-271oС при 2,5×106 Па).
Гелий по сравнению с другими элементами обладает наибольшей энергией ионизации атома (24,59 эВ). Особая устойчивость электронной структуры атома отличает гелий от остальных элементов Периодической системы Д.И. Менделеева.
Гелий хуже других газов растворяется в воде и других растворителях. В 1 л воды, например, растворяется при 0oС менее 10 мл гелия, т.е. в два с лишним раза меньше, чем молекул водорода (H2), и в 51000 раз меньше, чем молекул хлороводорода (HCl).
После водорода гелий – самый легкий из всех газов. Он более чем в 7 раз легче воздуха.
Валентность гелия в соединениях
Ядро атома гелия содержит два протона и два нейтрона (массовое число гелия равно 4-м). Как и в атоме водорода, у гелия есть всего один энергетический уровень, на котором находятся два электрона (рис. 1).
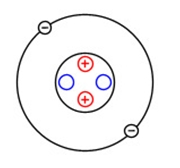
Рис. 1. Строение атома гелия.
Электронная формула атома гелия в основном состоянии выглядит следующим образом:
1s2.
А энергетическая диаграмма:

Поскольку на s-подуровне может содержаться не более 2-х электронов, то внешний энергетический уровень гелия является завершенным. В этой связи гелий является малоактивным химическим элементом и выделен в группу инертных газов. Т.е., можно сказать, что валентность гелия равна нулю.
Однако, при сильном возбуждении атомов он может образовывать молекулярные ионы He+2[σ2sσ*1s]. В обычных условиях эти ионы неустойчивы; захватывая недостающий электрон, они распадаются на два нейтральных атома. Возможно также образование ионизированных молекул HeH+[σ2s].
Примеры решения задач
| Задание | Определите валентность элементов в следующих соединениях: а) CuO; б) Au2O; в) PbO2; г) Li3N; д) AlF3. |
| Решение | Определение валентностей элементов в химическом соединении стоит начинать с указания валентности известного элемента. В варианте «а» — это кислород, поскольку его валентность всегда равна II:
CuOII. Далее определяем общее число единиц валентности атомов этого элемента: 2 × 1 =2. Проставляем полученное значение справа от химического знака этого элемента, обозначая арабскими цифрами: CuOII (2). Теперь делим общее число единиц валентности на число атомов (индекс) элемента, для которого известна валентность: 2 / 1 = 2. Поставим полученное частное (2) римской цифрой над искомым элементом как его валентность: CuIIOII. Значит валентность элементов в соединении CuO равна: у меди – II и у кислорода – II. Аналогичным образом определяем валентности элементов в других соединениях: б) AuI2OII; в) PbIVOII2; г) LiI3NII; д) AlIIIFI3. |
| Ответ | а) CuIIOII;б) AuI2OII; в) PbIVOII2; г) LiI3NII; д) AlIIIFI3. |
| Задание | Определите валентность элементов в следующих соединениях: а) CO; б) N2O; в) Mn2O7; г) N2O5; д) Cr2O3. |
| Решение | Определение валентностей элементов в химическом соединении стоит начинать с указания валентности известного элемента. В варианте «а» — это кислород, поскольку его валентность всегда равна II:
COII. Далее определяем общее число единиц валентности атомов этого элемента: 2 × 1 =2. Проставляем полученное значение справа от химического знака этого элемента, обозначая арабскими цифрами: COII (2). Теперь делим общее число единиц валентности на число атомов (индекс) элемента, для которого известна валентность: 2 / 1 = 2. Поставим полученное частное (2) римской цифрой над искомым элементом как его валентность: CIIOII. Значит валентность элементов в соединении CO равна: у углерода – II и у кислорода – II. Аналогичным образом определяем валентности элементов в других соединениях: б) NI2OII; в) MnVII2OII7; г) NV2OII5; д) CrIII2OII3. |
| Ответ | а) CIIOII;б) NI2OII; в) MnVII2OII7; г) NV2OII5; д) CrIII2OII3. |











