Валентность бора
Общие сведения о валентности бора
Бор имеет более 10 аллотропных модификаций (видоизменений) (явление аллотропии связано с существованием одного химического элемента в виде нескольких простых веществ – аллотропных модификаций). Атомы бора объединены в группировки B12, имеющие форму икосаэдра – двадцатигранника (рис. 1).
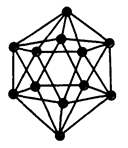
Рис. 1. Икосаэдрическая группировка атомов бора B12.
Расположение икосаэдров B12 относительно друг друга в кристалле показано ниже:
Кристаллы бора темно-серого цвета, тугоплавки (температура плавления 2075oС, температура кипения 3700oС), диамагнитны, обладают полупроводниковыми свойствами (рис. 2).

Рис. 2. Бор. Внешний вид.
Валентность бора в соединениях
Бор — пятый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится во втором периоде во IIIA группе. В ядре атома бора содержится 5 протонов и 5 нейтронов (массовое число равно 10). В атоме бора есть два энергетических уровня, на которых находятся 5 электронов.
Электронная формула атома борав основном состоянии имеет следующий вид:
1s22s22p1.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
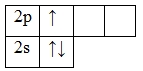
В основном состоянии в атоме бора есть 2 спаренных и 1 неспаренный электрон, а также 2 вакантные орбитали 2p-подуровня. За счет их наличия электроны 2s-подуровня могут распариваться и один из них совершает переход и занимает одну из свободных 2p орбиталей, т.е. для бора характерно возбужденное состояние.
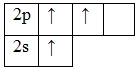
Наличие трех неспаренных электронов свидетельствует о том, что бор в своих соединениях (BIIIF3, BIII2O3, KBIIIF4, BIIIBr3и др.) проявляет валентность равную III.Этот факт также можно подтвердить тем, что высшая валентность элементов определяется по номеру группы, в которой он находится в Периодической таблице. Т.к. бор – элемент III группы, то его высшая валентность равна III. Валентность бериллия постоянна.
Примеры решения задач
| Задание | Определите валентность элементов в следующих соединениях: а) Mg3P2; б) Al2S3; в) Na2O; г) AgCl; д) FeCl3. |
| Решение | Определение валентностей элементов в химическом соединении стоит начинать с указания валентности известного элемента. В варианте «а» — это магний, поскольку элементы IIA группы имеют постоянное значение валентности, равное номеру группы, т.е. II. Запишем формулу вещества и укажем римскими цифрами валентность известного элемента:
MgII3P2. Находим наименьшее кратное чисел единиц валентностей. Для этого умножаем значение валентности магния на количество атомов данного элемента в соединении (3): 2 × 3 = 6. Чтобы определить валентность фосфора поделим наименьшее кратное чисел единиц валентностей на количество атомов фосфора в соединении (2): 6 / 2 = 3. Это означает, что валентность фосфора равна III: MgII3PIII2. Аналогичным образом определяем валентности элементов в других соединениях: б) AlIII2SII3; в) NaI2OII; г) AgIClI; д) FeIIIClI3. |
| Ответ | а) MgII3PIII2;б) AlIII2SII3; в) NaI2OII; г) AgIClI; д) FeIIIClI3. |
| Задание | Определите валентность элементов в следующих соединениях: а) Al4C3; б) Cl2O5; в) HBr; г) WO3; д) BaH2. |
| Решение | Определение валентностей элементов в химическом соединении стоит начинать с указания валентности известного элемента. В варианте «а» — это алюминий, поскольку для него постоянное значение валентности, равное номеру группы, в которой он расположен, т.е. III. Запишем формулу вещества и укажем римскими цифрами валентность известного элемента:
AlIII4C3. Находим наименьшее кратное чисел единиц валентностей. Для этого умножаем значение валентности алюминия на количество атомов данного элемента в соединении (4): 3 × 4 = 12. Чтобы определить валентность углерода поделим наименьшее кратное чисел единиц валентностей на количество атомов углерода в соединении (3): 12 / 3 = 4. Это означает, что валентность углерода равна IV: AlIII4CIV3. Аналогичным образом определяем валентности элементов в других соединениях: б) ClV2OII5; в) HIBrI; г) WVIOII3; д) BaIIHI2. |
| Ответ | а) AlIII4CIV3;б) ClV2OII5; в) HIBrI; г) WVIOII3; д) BaIIHI2. |











