Валентность бериллия
Общие сведения о валентности бериллия
Бериллий в виде простого вещества – металл (температура плавления 1287oС, температура кипения 2507oС) серо-стального цвета, имеет плотную гексагональную кристаллическую решетку, довольно тверд и хрупок (рис. 1).

Рис. 1. Бериллий. Внешний вид.
На воздухе покрывается оксидной пленкой, придающей ему матовый оттенок и обусловливающей пониженную химическую активность. При нагревании бериллий сгорает в кислороде и на воздухе.
Валентность бериллия в соединениях
Бериллий — четвертый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится во втором периоде во IIA группе. В ядре атома бериллия содержится 4 протона и 5 нейтронов (массовое число равно 9). В атоме бериллия есть два энергетических уровня, на которых находятся 4 электрона (рис. 2).
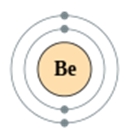
Рис. 2. Строения атома бериллия.
Электронная формула атома бериллия в основном состоянии имеет следующий вид:
1s22s2.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):

В атоме бериллия есть 3 вакантные орбитали 2p-подуровня. За счет их наличия электроны 2s-подуровня могут распариваться и один из них совершает переход и занимает одну из свободных 2p орбиталей, т.е. для бериллия характерно возбужденное состояние.
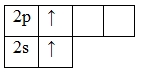
Наличие двух неспаренных электронов свидетельствует о том, что бериллий в своих соединениях (BeIIO, BeII(OH)2, BeIICO3 и др.) проявляет валентность равную II, как и другие химические элементы IIA группы. Валентность бериллия постоянна.
Примеры решения задач
| Задание | Определите валентность элементов в следующих соединениях: а) NH3; б) SO2; в) CO2; г) H2S; д) P2O5. |
| Решение | Определение валентностей элементов в химическом соединении стоит начинать с указания валентности известного элемента. В варианте «а» — это водород, поскольку его валентность всегда равна I:
NHI3. Далее определяем общее число единиц валентности атомов этого элемента: 1 × 3 =3. Проставляем полученное значение справа от химического знака этого элемента, обозначая арабскими цифрами: NHI3 (3). Теперь делим общее число единиц валентности на число атомов (индекс) элемента, для которого известна валентность: 3 / 1 = 3. Поставим полученное частное (3) римской цифрой над искомым элементом как его валентность: NIIIHI3. Значит валентность элементов в соединении NH3 равна: у азота – III и у водорода – I. Аналогичным образом определяем валентности элементов в других соединениях: б) SIVOII2; в) CIVOII2; г) HI2SII; д) PV2OII5. |
| Ответ | а) NIIIHI3;б) SIVOII2; в) CIVOII2; г) HI2SII; д) PV2OII5. |
| Задание | Напишите формулы кислородных соединений (оксидов) следующих элементов: а) бериллия (II); б) кремния (IV); в) калия (I); г) мышьяка (V). |
| Ответ | Известно, что валентность кислорода в соединениях всегда равна II. Для того, чтобы составить формулу вещества (оксида) нужно осуществить следующую последовательность действий. Сначала записываем химические знаки элементов, входящих в состав сложного вещества и ставим над знаком каждого элемента валентность римской цифрой:
BeIIOII; SiIVOII; KIOII; AsVOII. Находим наименьшее кратное чисел единиц валентностей: а) (II×II) = 4;б) (IV×II) = 8; в) (I×II) = 2; г) (V×II) = 10. Разделим наименьшее общее кратное на число единиц валентности каждого элемента в отдельности (полученные частные и будут индексами в формуле): а) 4/2 = 2 и 4/2 = 2, следовательно, формула оксида BeO; б) 8/4 = 2 и 8/2 = 4, следовательно, формула оксида SiO2; в) 2/1 = 2 и 2/2 = 1, следовательно, формула оксида K2O; г) 10/5 = 2 и 10/2 = 5, следовательно, формула оксида As2O5. |











