Валентность бария
Общие сведения о валентности бария
В виде простого вещества барий – серебристо-белый металл, который на воздухе покрывается желтоватой пленкой продуктов взаимодействия с составными частями воздуха. Барий по твердости напоминает свинец. Плотность 3,76 г/см3. Температура плавления 727oС, кипения 1640oС.Имеет объемно центрированную кристаллическую решетку.
Валентность бария в соединениях
Барий – пятьдесят шестой по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в шестом периоде в IIA группе. В ядре атома бария содержится 56 протонов и 81 нейтрон (массовое число равно 137). В атоме бария есть шесть энергетических уровней, на которых находятся 56 электронов (рис. 1).
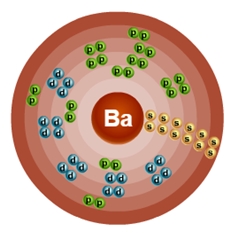
Рис. 1. Строение атома бария.
Электронная формула атома бария в основном состоянии имеет следующий вид:
1s22s22p63s23p63d104s24p64d105s25p66s2.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):

Для атома бария характерно наличие возбужденного состояний из-за того, что орбитали 6p-подуровня являются вакантными. Электроны 6s-подуровня распариваются и занимают свободную орбиталь 6p -подуровня:
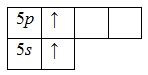
Наличие двух неспаренных электронов в возбужденном состоянии свидетельствует о том, что барий проявляет в своих соединениях валентность II(BaO, Ba(OH)2, BaSO4, Ba(NO3)2 и др.) (постоянная валентность).
Примеры решения задач
| Задание | Составьте уравнения реакций гидролиза нитрита бария. Какова будет реакция среды в растворе этой соли? |
| Решение | Запишем уравнение диссоциации соли:
Ba(NO2)2 ↔ Ba2+ + 2NO2—. Соль образована сильным основанием – гидроксидом бария (Ba(OH)2) и слабой кислотой – азотистой (HNO2), следовательно, гидролиз протекает по аниону и в одну ступень: NO2— + HOH ↔ HNO2 + OH—; Ba(NO2)2+ 2H2O ↔ 2HNO2 + Ba(OH)2. Реакция среды – щелочная, о чем свидетельствует присутствие в растворе гидроксид-ионов. |
| Задание | Определите массу бария, которая потребуется для приготовления 150 г 25 — %-го раствора гидроксида бария. |
| Решение | Запишем уравнение реакции:
Ba +2H2O = Ba(OH)2 + H2↑. Найдем массу гидроксида бария в растворе: ω = msolute/ msolution × 100%; msolute = ω / 100% ×msolution; msolute(Ba(OH)2) = ω (Ba(OH)2) / 100% ×msolution (Ba(OH)2); msolute(Ba(OH)2) = 25 / 100% × 150 = 37,5 г. Вычислим количество вещества гидроксида бария (молярная масса – г/моль): n = m/ M; n(Ba(OH)2) = m(Ba(OH)2)/ M(Ba(OH)2); n(Ba(OH)2) = 37,5/ 171 = 0,22 моль. Согласно уравнению реакции n(Ba(OH)2):n(Ba)=1:1, т.е. n(Ba(OH)2) = n(Ba) = 0,22 моль. Тогда, масса бария (молярная масса – 137 г/моль): m(Ba) = n(Ba) × M(Ba) m(Ba) = 0,22×137 = 30,14 г |
| Ответ | Масса бария равна 30,14 г. |











