Валентность азота
Общие сведения о валентности азота
Азот – типичный неметаллический элемент, по электроотрицательности (3,0) уступает лишь фтору и кислороду.
Природный азот состоит из двух устойчивых изотопов 14N (99,635%) и 15N (0,365%).
Молекула азота двухатомна. Между атомами азота в молекуле есть тройная связь, вследствие чего молекула N2 исключительно прочная. Молекулярный азот химически малоактивен, слабо поляризуется.
В обычных условиях молекулярный азот – газ. Температуры плавления (-210oС) и кипения (-195,8oС) азота очень низкие; он плоха растворяется в воде и других растворителях.
Валентность азота в соединениях
Азот — седьмой по счету элемент Периодической таблицы Д.И. Менделеева. Он находится во втором периоде во VA группе. В ядре атома азота содержится 7 протонов и 7 нейтронов (массовое число равно 14). В атоме азота есть два энергетических уровня, на которых находятся 7 электронов (рис. 1).
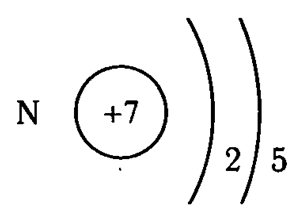
Рис. 1. Строения атома азота.
Электронная формула атома азота в основном состоянии имеет следующий вид:
1s22s22p3.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
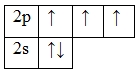
Наличие трех неспаренных электронов свидетельствует о том, что азот может проявлять валентность III в своих соединения (NIII2O3, NIIIH3, HNIIIO2).
Известно, что помимо трех ковалентных связей, образуемых по обменному типу, азот способен образовывать ещё одну (т.е. в сумме четыре) по донорно-акцепторому механизму за счет наличия неподеленной пары электронов, находящейся на 2s-подуровне. Это означает, что азот также может проявлять в своих соединениях валентность IV (NIVO2).
Так как на 2 энергетическом слое нет подуровней кроме 2s и 2p, которые уже заняты электронами, возбужденного состояния у азота нет.
Ранее считалось, что высшая валентность азота равна V – соответствует номеру группы, в которой этот элемент расположен (NV2O5, HNVO3). Однако, квантово-механические исследования показали, что такая валентность для азота не характерна (рис. 2). Степень окисления +5 у азота есть, а валентности равной V – нет.
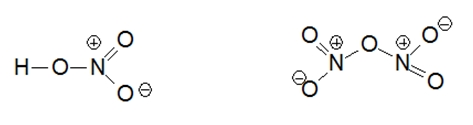
Рис. 2. Структурные формулы азотной кислоты и оксида азота (V).
Также для азота характерно проявление валентностей I (NI2O) и II (NO).
Примеры решения задач
| Задание | Укажите, чему равны валентности элементов, входящих в состав перечисленных соединений: Mn2O7, MgO, Cl2O, CaO, Cl2O7и CrO. |
| Ответ | Определение валентностей элементов в химическом соединении стоит начинать с указания валентности известного элемента. Все перечисленные выше соединения относятся к классу оксидов. Валентность кислорода в оксидах всегда равна II. Рассмотрим на примере первого вещества. Запишем его формулу и укажем римскими цифрами валентность известного элемента:
Mn2OII7. Находим наименьшее кратное чисел единиц валентностей. Для этого умножаем значение валентности кислорода на количество атомов данного элемента в соединении (7): 2 × 7 = 14. Чтобы определить валентность марганца поделим наименьшее кратное чисел единиц валентностей на количество атомов марганца в соединении (2): 14 / 2 = 7. Это означает, что валентность марганца равна VII: MnVII2OII7. Аналогичным образом определяем валентности элементов в других соединениях: MgIIOII, ClI2OII, CaIIOII, ClVII2OII7и CrIIOII. |
| Задание | Среди перечисленных веществ класса оксидов CO2, Fe2O3, SO3, CaO, Cl2O7, CrO3 выберете те, в которых элементы проявляют одинаковые валентности. |
| Ответ | Так как все вышеуказанные соединения относятся к классу оксидов, следовательно, валентность кислорода в них равна II. Расставим валентности других элементов, входящих в состав оксидов: CIVOII2, FeIII2OII3, SVIOII3, CaIIOII, ClVII2OII7, CrVIOII3. Смысл вопроса задания можно понять двояко: либо нужно указать соединения, в которых элемент также и кислород проявляет валентность равную II (одинаковые валентности), либо – соединения в которых одинаковая валентность элемента (без учета валентности кислорода). В первом случае ответ – оксид кальция (CaIIOII), а во втором – оксид хрома (VI) (CrVIOII3) и оксид серы (VI) (SVIOII3), поскольку и сера и хром проявляют валентность равную VI. |











