Степень окисления бора
Общие сведения о степени окисления бора
Бор имеет более 10 аллотропных модификаций (видоизменений) (явление аллотропии связано с существованием одного химического элемента в виде нескольких простых веществ – аллотропных модификаций). Атомы бора объединены в группировки B12, имеющие форму икосаэдра – двадцатигранника (рис. 1).
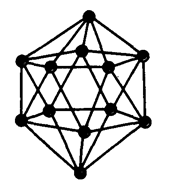
Рис. 1. Икосаэдрическая группировка атомов бора B12.
Расположение икосаэдров B12 относительно друг друга в кристалле показано ниже:
Кристаллы бора темно-серого цвета, тугоплавки (температура плавления 2075oС, температура кипения 3700oС), диамагнитны, обладают полупроводниковыми свойствами (рис. 2).

Рис. 2. Бор. Внешний вид.
Степень окисления бора в соединениях
Бор существует в виде нескольких простых веществ – аллотропных модификаций (см. выше), в которых его степень окисления равна нулю. Эту же степень окисления он проявляет в соединениях под названием бориды (могут иметь состав Me4B, Me2B, MeB, Me3B4, MeB2, MeB6и MeB12, где Me – атом металла), например в боридах ниобия или хрома Nb2B, Nb3B4, Cr4B, Cr2B, CrB2.
В соединениях с более электроотрицательными элементами, чем он сам бор проявляет степень окисления (+3), т.е. в галогенидах (B+3F-13), оксиде (B+32O-23), сульфиде (B+32S-23), нитриде (B+3N-3), гидридах (B+3H-13) и в соответствующих борат-комплексах (B+3F4—, [B+3F3OH]—, B+3O2—, [B+3(OH)4]—, B+3H4—, [B+3F3H]—, B+3S2—).
Примеры решения задач
| Задание | Составьте уравнения электронной нейтральности для молекул: а) H+1Br-1; б)H+1N+5O-23; в) H+12S+6O-24; г) H+13P+5O-24. |
| Ответ | Уравнение электронейтральности составляют на основе следующего правила. Алгебраическая сумма степеней окисления всех элементов в соединении равна нулю.
а) 1×(+1) + 1×(-1) = 0; б) 1×(+1) + 1×(+5) + 3×(-2) = 0; в) 2×(+1) + 1×(+6) + 4×(-2) = 0; г) 3×(+1) + 1×(+5) + 4×(-2) = 0. |
| Задание | Определите степени окисления кислотообразующих элементов в следующих соединениях: HClO, HClO2, HClO3 и HClO4. |
| Решение | Во всех указанных соединениях кислотообразующим элементом является хлор. Степень окисления кислорода равна (-2), а водорода – (+1). Примем за «х» степень окисления хлора и при помощи уравнения электронейтральности найдем значения степеней окисления хлора в указанных соединениях:
1 + x + (-2) = 0; x -1 = 0; x = +1. 1 + x + 2×(-2) = 0; x -3 = 0; x = +3. 1 + x + 3×(-2) = 0; x -5 = 0; x = +5. 1 + x + 4×(-2) = 0; x -7 = 0; x = +7. Степени окисления хлора равны (+1), (+3), (+5) и (+7). |
| Ответ | HCl+1O, HCl+3O2, HCl+5O3 и HCl+7O4. |











