Степень окисления в N2O3
Общие сведения об оксиде азота (III) и степени окисления в N2O3
В твердом состоянии это вещество белого или голубоватого цвета с ионным строением носящее название нитрит нитрозила (NO+) (NO2—). В виде газообразного вещества имеет молекулярное строение, показанное на рис. 1. Брутто-формула – N2O3. Молярная масса оксида азота (III) – 76,01 г/моль.
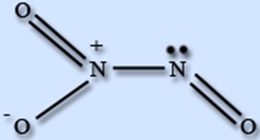
Рис. 1. Строение молекулы оксида азота (III).
Проявляет кислотные свойства.
N2O3, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав оксида азота (III), сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Степень окисления кислорода в оксидах всегда равна ( — 2). Для нахождения степени окисления азота примем её значение за «х» и определим его при помощи уравнения электронейтральности:
2×х + 3× (-2)= 0;
2х – 6 = 0;
2х = 6;
x = +3.
Степень окисления азота в оксиде азота (III) равна (+3):
N+32O-23.
Примеры решения задач
| Задание | Установите соответствие между свойствами азота и уравнением окислительно-восстановительной реакции, в которой он проявляет в этой реакции.
|
||||||||||
| Ответ | а) В данной реакции степень окисления азота изменяется с (-3) в NH3 до (+2) в NO. Так как степень окисления повысилась, то азот выступает в роли восстановителя. Вариант 2.
б) В данной реакции степень окисления азота изменяется с 0 в N2 до (-3) в Li3N. Так как степень окисления понизилась, то азот выступает в роли окислителя. Вариант 1. в) В данной реакции степень окисления азота не изменяется: она равна (-3) как в NH4Cl, так и в NH3. Это означает, то азот не является ни окислителем, ни восстановителем. Вариант 4. г) В данной реакции степень окисления азота изменяется с (+4) в NO2 до (+5) в HNO3. Так как степень окисления повысилась, то азот выступает в роли восстановителя. Вариант 2. |
| Задание | Наименьшую степень окисления марганец имеет в соединении: а) MnSO4; б) MnO2; в) K2MnO4; г) Mn2O3. |
| Решение | Будем поочередно определять степень окисления марганца в каждом из соединений, а выберем то, в котором его степень окисления наименьшая.
а) Сульфат марганца (II) — MnSO4. Сульфаты – это соли серной кислоты, брутто-формула, которой имеет вид H2SO4. В составе серной кислоты имеется два атома водорода, следовательно, степень окисления кислотного остатка (сульфат-иона) равна (-2). Степень окисления кислорода в составе неорганических кислот, а, значит и их кислотных остатков, всегда равна (-2).Для нахождения степени окисления серы в сульфат ионе примем её значение за «х» и определим его при помощи уравнения электронейтральности: x + 4×(-2) = -2; x — 8 = -2; x = +6. Значит степень окисления серы в составе сульфат-иона равна (+6). Определим степень окисления марганца в сульфате марганца (II) аналогичным способом: y + (+6) + 4×(-2) = 0; y + 6 – 8 = 0; y -2 = 0; y = +2. Следовательно, степень окисления марганца равна (+2). Это наименьшая положительная степень окисления, которую марганец способен проявлять в своих соединениях, следовательно, это верный ответ. |
| Ответ | Вариант (а) |











