Степень окисления в MnSO4
Общие сведения о сульфате марганца (II) и степени окисления в MnSO4
Бруттно-формула – MnSO4. Молярная масса сульфата марганца (II) – 151 г/моль.Температура плавления равна 700oC. Хорошо растворим в воде (гидролизуется по катиону). В водном растворе способен образовывать кристаллогидраты, имеющие красновато-розовый цвет (рис. 1). В ОВР может проявлять себя в роли слабого восстановителя.
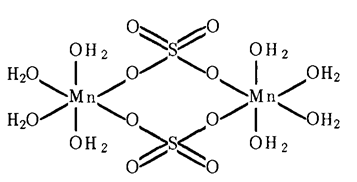
Рис. 1. Структура кристаллогидратов сульфата марганца (II) состава MnSO4×4H2O.
MnSO4, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав сульфата марганца (II), сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Известно, что суммарная степень окисления кислотного остатка определяется числом атомов водорода, входящих в состав кислоты и записывается со знаком минус. Сульфаты – это соли серной кислоты, брутто-формула, которой имеет вид H2SO4. В составе серной кислоты имеется два атома водорода, следовательно, степень окисления кислотного остатка (сульфат-иона) равна (-2): SO42-.
Степень окисления кислорода в составе неорганических кислот, а, значит и их кислотных остатков, всегда равна (-2).Для нахождения степени окисления серы в сульфат ионе примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 4×(-2) = -2;
x — 8 = -2;
x = +6.
Значит степень окисления серы в составе сульфат-иона равна (+6). Определим степень окисления марганца в сульфате марганца (II) аналогичным способом:
y + (+6) + 4×(-2) = 0;
y + 6 – 8 = 0;
y -2 = 0;
y = +2.
Следовательно, степень окисления марганца равна (+2):
Mn+2S+6O-24.
Примеры решения задач
| Задание | Одинаковую степень окисления хром имеет в каждом из двух соединений:
|
| Решение | Чтобы дать правильный ответ на поставленный вопрос определим степень окисления хрома в каждой из предложенных пар химических соединений. Для этого будем принимать за «х» степень окисления хрома и составлять уравнения электронейтральности.
а) Степень окисления хлора в хлориде хрома равна (-1). Степень окисления кислорода в оксидах всегда равна (-2). Тогда, степень окисления хрома будет равна: x + 3×(-1) = 0; x = +3. y + 3×(-2) = 0; y = +6. Ответ неверный. б) Степень окисления калия всегда равна (+1). Степень окисления кислорода в данных соединениях равна (-2). Тогда, степень окисления хрома будет равна: 1 +х + 2×(-2) = 0; x – 3 = 0; x = +3. 2×1 + у + 4×(-2) = 0; y -6 = 0; y = +6. Ответ неверный. в) Степень окисления калия всегда равна (+1). Степени окисления кислорода и водорода в данных соединениях равны (-2) и (+1) соответственно. Тогда, степень окисления хрома будет равна: 2×1 + х + 4×(-2) = 0; x -6 = 0; x = +6. 2×1 + 2×у + 7×(-2) = 0; 2у -12 = 0; 2у = +12; y = +6. Верный ответ. |
| Ответ | Вариант 3 |
| Задание | Установите соответствие между схемой окислительно-восстановительной реакции и коэффициентом перед формулой восстановителя.
|
|||||||||||
| Ответ | Элемент-восстановитель в ходе реакции повышает свою степень окисления. Запишем все уравнения реакций и укажем в них элементы, которые изменяют значение степени окисления и уравняем их.
2N-3H3 + 3Cu+2O = 3Cu0 + N02 + 3H2O. В данной реакции степень окисления изменяют элементы азот и медь: N-3 → N0; Cu+2 → Cu0. Азот повышает степень окисления, следовательно, аммиак является восстановителем. Перед формулой этого вещества нужно поставить коэффициент равный 2-м. 4N-3H3 + 5O02 = 4N+2O + 6H2O-2. В данной реакции степень окисления изменяют элементы азот и кислород: N-3 → N+2; O0 → O-2. Азот повышает степень окисления, следовательно, аммиак является восстановителем. Перед формулой этого вещества нужно поставить коэффициент равный 4-м. 4HN+5O3 + Cu0 = Cu+2(NO3)2 + 2N+4O2 + 2H2O. В данной реакции степень окисления изменяют элементы азот и медь: N+5 → N+4; Cu0 → Cu+2. Медь повышает степень окисления, следовательно, она является восстановителем. Перед формулой этого вещества коэффициент не требуется (равен 1). 6Li0 + N02 = 2Li+13N-3. В данной реакции степень окисления изменяют элементы азот и литий: N0 → N-3; Li0 → Li+1. Литий повышает степень окисления, следовательно, он является восстановителем. Перед формулой этого вещества нужно поставить коэффициент равный 6-ти. |











