Степень окисления в H3PO4
Общие сведения об ортофосфорной кислоте и степени окисления в H3PO4
Плавится без разложения (42,35oC). В жидком состоянии склонна к переохлаждению, при умеренном нагревании разлагается. Брутто-формула – H3PO4 (строение молекулы показано на рис. 1). Молярная масса фосфорной кислоты равна 97,99 г/моль.
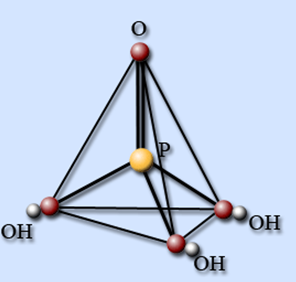
Рис. 1. Строение молекулы ортофосфорной кислоты.
Хорошо растворяется в воде. Является слабой кислотой.
H3PO4, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав ортофосфорной (фосфорной) кислоты, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Степени окисления водорода и кислорода в составе неорганических кислот всегда равны (+1) и (-2) соответственно. Для нахождения степени окисления фосфора примем её значение за «х» и определим его при помощи уравнения электронейтральности:
3×(+1) + х + 4×(-2) = 0;
3 + х — 8 = 0;
x — 5 = 0;
x = +5.
Значит степень окисления фосфора в ортофосфорной кислоте равна (+5):
H+13P+5O-24.
Примеры решения задач
| Задание | Составьте уравнения электронной нейтральности для молекул: а) H+1Br-1; б)H+1N+5O-23; в) H+12S+6O-24; г) H+13P+5O-24. |
| Ответ | Уравнение электронейтральности составляют на основе следующего правила. Алгебраическая сумма степеней окисления всех элементов в соединении равна нулю.
а) 1×(+1) + 1×(-1) = 0; б) 1×(+1) + 1×(+5) + 3×(-2) = 0; в) 2×(+1) + 1×(+6) + 4×(-2) = 0; г) 3×(+1) + 1×(+5) + 4×(-2) = 0. |
| Задание | Максимально возможную степень окисления азот проявляет в а) нитриде кальция; б) нитрите аммония; в) хлориде аммония; г) нитрате цинка? |
| Решение | Для того, чтобы дать правильный ответ на поставленный вопрос будем поочередно определять степень окисления азота в каждом из предложенных соединений с помощью уравнения электронейтральности.
а) Формула нитрида кальция – Ca3N2. Степень окисления кальция всегда равна (+2). Примем за «х» значение степени окисления азота: 3×2 + 2×х = 0; 2х +6 =0; 2х = -6; x = -3. б) Формула нитритааммония –NH4NO2. Степень окисления азота в составе иона аммония равна (-3), а в составе нитрит-иона – (+3). в) Формула хлоридааммония –NH4Cl. Как было уже сказано в варианте (б), степень окисления азота в составе иона аммония равна (-3). г) Формула нитрата цинка – Zn(NO3)2.Степень окисления цинка всегда равна (+2). Степень окисления кислорода в данном случае равна (-2). Примем за «х» значение степени окисления азота: 2 + 2×х + 6×(-2) = 0; 2х -10 =0; 2х = 10; x = +5. Это верный ответ, поскольку максимально возможная степень окисления азота равна (+5). |
| Ответ | Вариант 4 |











