Степень окисления в H2SO3
Общие сведения о сернистой кислоте и степени окисления в H2SO3
Существует в водном растворе только при концентрации не более 6%, в остальных случаях сразу же разлагается на диоксид серы и воду. Брутто-формула – H2SO3 (структурная формула приведена на рис. 1). Молярная масса сернистой кислоты равна 82,07 г/моль. Плотность – 1,03 г/см3.
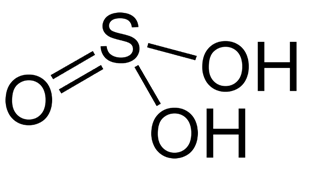
Рис. 1. Структурная формула сернистой кислоты.
H2SO3, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав сернистой кислоты, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Степени окисления водорода и кислорода в составе неорганических кислот всегда равны (+1) и (-2) соответственно. Для нахождения степени окисления серы примем её значение за «х» и определим его при помощи уравнения электронейтральности:
2× (+1) + х + 3×(-2) = 0;
2 + х — 6 = 0;
x — 4 = 0;
x = +4.
Значит степень окисления серы в сернистой кислоте равна (+4):
H+12S+4O-23.
Примеры решения задач
| Задание | Напишите формулы оксида азота со следующими степенями окисления: а) +1; б) +2; в) +3; г) +4; д) +5. |
| Ответ | а) Для составления формулы оксида азота со степенью окисления равной (+1) необходимо сначала записать химические знаки элементов, входящих в состав сложного вещества:
NO. Затем указываем степени окисления этих элементов, учитывая, что степень окисления кислорода в составе оксидов всегда равна (-2): N+1O-2. Находим наименьшее общее кратное: 1 × 2 = 2 (знаки не учитываем). Разделим наименьшее общее кратное на число единиц степени окисления каждого элемента в отдельности (полученные частные и будут индексами в формуле): 1 / 2 = 2; 2 / 2 = 1. Таким образом формула оксида азота со степенью окисления равной (+1) будет иметь следующий вид: N2O. Аналогичным образом составляем формулы других оксидов: б) NO; в)N2O3; г) NO2; д)N2O5. |
| Задание | Напишите графические формулы следующих соединений: а) N2; б) H2O2; в) CO2; г) HMnO4; д) KMnO4. Укажите степени окисления элементов, входящих в состав вышеуказанных веществ. |
| Ответ | а) графическая формула молекулы азота имеет вид:
N ≡ N. В соединениях с неполярными связями степень окисления элементов равна нулю: N02. б) графическая формула молекулы пероксида водорода имеет вид: H-O-O-H. Пероксид водорода, как и вода, представляет собой гидрид кислорода, а которых водород, как известно, проявляет степень окисления (+1). Для нахождения степени окисления кислорода примем её значение за «х» и определим его при помощи уравнения электронейтральности: 2× (+1) + 2×х = 0; 2 + 2х = 0; 2х = -2; x = -1. Значит степень окисления кислорода в пероксиде водорода равна (-1): H+12O-12. Аналогичным образом определяем степени окисления элементов в других соединениях. в) O=C-C+O, C+4O-22; г)H+1Mn+7O-24 Графическая формула марганцовой кислоты аналогична записанной для перманганата калия, в которой на месте иона калия будет находиться ион водорода. д)K+1Mn+7O-24 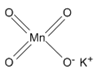
|











