Степень окисления в FeS2
Общие сведения о пирите и степени окисления в FeS2
Брутто-формула – FeS2. Молярная масса дисульфида железа равна 119,98 г/моль. Термически устойчив (температура плавления – 743oС).
Не растворяется в воде. Разлагается кислотами-окислителями. Окисляется при прокаливании на воздухе.
FeS2, степени окисления элементов в нем
Как следует из названия, данное вещество является сульфидом. Степень окисления кислотного остатка определяется числом атомов водорода, входящих в состав образующей его кислоты, указанных со знаком минус. Сульфид-ион – это кислотный остаток сероводородной кислоты, формула которой H2S. В её составе имеется два атома водорода, следовательно, степень окисления серы в сульфид-ионе равна (-2).
Для нахождения степени окисления железа примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 2×(-2) = 0;
x -4 = 0;
x = +4.
Значит степень окисления железа в дисульфиде железа равна (+4):
Fe+4S-22.
Примеры решения задач
| Задание | Напишите графические формулы следующих соединений: а) O2; б) SO3; в) CaCO3. Укажите степени окисления элементов, входящих в состав вышеуказанных веществ. |
| Ответ | а) графическая формула молекулы кислорода имеет вид:
O=O. В соединениях с неполярными связями степень окисления элементов равна нулю: O02. б) графическая формула молекулы оксида серы (VI) имеет вид: 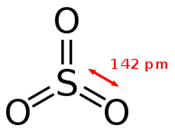
Степень окисления кислорода в оксидах всегда равна (-2). Для нахождения степени окисления серы примем её значение за «х» и определим его при помощи уравнения электронейтральности: x+ 3×(-2) = 0; x- 6 = 0; x = +6. Значит степень окисления серы в оксиде серы (VI) равна (+6): S+6O-23. в) графическая формула молекулы карбоната кальция имеет вид: 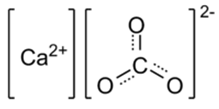
Степень окисления кислорода в кислотах, а, следовательно, и в их остатках, всегда равна (-2). Кальций имеет постоянную степень окисления, равную номеру группы Периодической системы Д.И. Менделеева, в которой он расположен, взятую со знаком плюс (кальций – металл), т.е. (+2). Для нахождения степени окисления углерода примем её значение за «х» и определим его при помощи уравнения электронейтральности: (+2) + х+ 3×(-2) = 0; 2 + х- 6 = 0; x- 4 = 0; x = +4. Значит степень окисления углерода в карбонате кальция равна (+4): Ca+2C+4O-23. |
| Задание | Напишите графические формулы следующих соединений: а) H2SO4; б) FeS; в) CH4. Укажите степени окисления элементов, входящих в состав вышеуказанных веществ. |
| Ответ | а) графическая формула молекулы серной кислоты имеет вид:
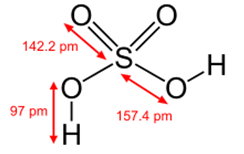
Степени окисления кислорода и водорода в кислотах всегда равны (-2) и (+1) соответственно. Для нахождения степени окисления серы примем её значение за «х» и определим его при помощи уравнения электронейтральности: 2× (+1) + х+ 4×(-2) = 0; 2 + х- 8 = 0; x- 6 = 0; x = +6. Значит степень окисления серы в серной кислоте равна (+6): H+12S+6O-24. б) графическая формула молекулы сульфида железа (II)имеет вид: 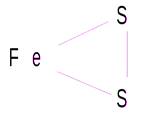
Степень окисления кислотного остатка определяется числом атомов водорода, входящих в состав образующей его кислоты, указанных со знаком минус. Сульфид-ион – это кислотный остаток сероводородной кислоты, формула которой H2S. В её составе имеется два атома водорода, следовательно, степень окисления серы в сульфид-ионе равна (-2). Для нахождения степени окисления железа примем её значение за «х» и определим его при помощи уравнения электронейтральности: x + (-2) = 0; x = +2. Значит степень окисления железа в сульфиде железа (II)равна (+2): Fe+2S-2. в)графическая формула молекулы метана имеет вид: 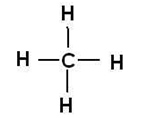
Метан – это гидрид углерода, а, как известно, степень окисления водорода в гидридах равна (+1). Для нахождения степени окисления углерода примем её значение за «х» и определим его при помощи уравнения электронейтральности: x+ 4×(+1) = 0; x+ 4 = 0; x = -4. Значит степень окисления углерода в метане (-4): C-4H+14. |











