Вода
Характеристики и физические свойства воды
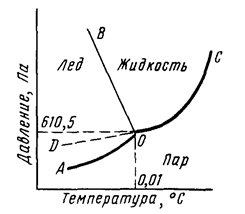
Рис. 1. Диаграмма состояния воды.
Кривая АО соответствует равновесию в системе лед-пар, DO – равновесию в системе переохлажденная вода-пар, кривая OC – равновесию в системе вода-пар, а кривая OB – равновесию в системе лед-вода. В точке О все кривые пересекаются. Эта точка называется тройной точкой и отвечает равновесию в системе лед-вода-пар.
Жидкая вода в тонких слоях бесцветна, а в толстых имеет голубовато-зеленый цвет. В противоположность почти всем другим веществам, плотность которых по мере охлаждения все время возрастает, вода имеет наибольшую плотность при +4oС – 1 г/см3.
Чистая вода практически не проводит электрический ток. Она характеризуется наибольшей из всех твердых и жидких веществ удельной теплоемкостью, т.е. для нагревания воды требуется затратить больше тепла, чем для нагревания на то же число градусов равного по массе количества какой-либо другой жидкости или твердого тела. Обратно. При охлаждении вода отдает больше тепла, чем равное количество любого твердого или жидкого вещества.
При низких температурах вода испаряется сравнительно медленно, но при нагревании давление её пара быстро возрастает.
В жидком состоянии вода ассоциирована, т.е. наряду с простыми молекулами содержит и более сложные образования, соответствующие общей формуле (H2O)n, где n = 2, 3, 4 и т.д. Подобные молекулярные агрегаты все время возникают и вновь распадаются, что можно выразить схемой:
n H2O ↔(H2O)n.
Примеры решения задач
| Задание | Необходимо приготовить 250 г 6%-ного раствора соли. Вычислите массу воды и соли, необходимую для приготовления подобного раствора. |
| Решение | Запишем формулу для расчета массовой доли растворенного вещества в растворе:
ω (X) = m(X) / msolution× 100%. Отсюда следует, что масса соли, необходимая для приготовления её 250 г 6%-ного раствора будет равна: msalt = ω (salt) × msolution; msal= 0,06 ×250 = 15 г. А масса воды составит: m(H2O) = msolution – msalt; m(H2O) = 250 – 15 = 235 г. |
| Ответ | Масса воды равна 235 г, масса соли равна 15 г. |
| Задание | Вычислите массу воды, необходимую для приготовления 50 г 10%-ного раствора соли. |
| Решение | Запишем формулу для расчета массовой доли растворенного вещества в растворе:
ω (X) = m(X) / msolution× 100%. Отсюда следует, что масса соли, необходимая для приготовления её 250 г 6%-ного раствора будет равна: msalt = ω (salt) × msolution; msalt = 0,1 ×50 = 5 г. А масса воды составит: m(H2O) = msolution – msalt; m(H2O) = 50 – 5 = 45 г. |
| Ответ | Масса воды равна 45 г, масса соли равна 5 г. |











