Сложные эфиры
Характеристики и физические свойства сложных эфиров
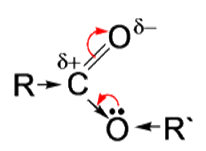
Рис. 1. Строение молекулы сложного эфира.
Сложные эфиры низших карбоновых кислот и простейших спиртов – это летучие жидкости, плохо растворяющиеся в воде, обычно имеющие приятный запах, легче воды (например, плотность изоамилацетата – 0,876 г/см3).
Сложные эфиры высших спиртов и карбоновых кислот – твердые, воскоподобные, напримерпальмитиновоцетиловый эфир (содержится в спермацете – одной из нуклеиновых кислот, участвующих в передаче наследственных признаков) и пальмитиновомирициловый эфир (содержится в пчелином воске).
Получение сложных эфиров
Основные способы получения сложных эфиров – это:
— взаимодействие кислот со спиртами
CH3-CH2-C(O)-H + C2H5OH↔CH3-C(O)-O-C2H5 + H2O (t0, H+);
— взаимодействие ангидридов карбоновых кислот со спиртами
CH3-C(O)-O-C(O)-CH3 + C2H5OH → CH3-C(O)-O-C2H5 + CH3COOH;
— взаимодействиегалогенангидридовкислотсоспиртами
CH3-C(O)-Cl + CH3-CH2-CH2-OH → CH3-C(O)-O-CH2-CH2-CH3 + HCl.
Химические свойства сложных эфиров
Химические свойства сложных эфиров обусловлены наличием функциональной группы. Наиболее важной является реакция гидролиза:
— кислотный гидролиз
CH3-C(O)-O-CH3 + H2O↔CH3COOH + CH3OH (t0, H+);
— щелочной гидролиз
CH3-C(O)-O-C2H5 + NaOH→CH3COONa + C2H5OH (t0).
Сложные эфиры вступают в реакции взаимодействия со следующими веществами:
— спиртами (реакция переэтерификации)
CH3-C(O)-O-C2H5 + CH3OH↔CH3-C(O)-O-CH3 + C2H5OH (t0, H+);
— с аммиаком
CH3-C(O)-O-C2H5 + NH3→CH3-C(O)-NH2 + C2H5OH (t0);
— галогенирования, если в составе углеводородного радикала имеются кратные связи
CH2=CH-C(O)-O-CH3 + Br2→ Br-CH2-C(Br)H-C(O)-O-CH3.
Применение сложных эфиров
Сложные эфиры применяются для изготовления искусственных эссенций, используемых в производстве фруктовых вод, кондитерских изделий, косметических средств, отдушек для препаратов бытовой химии и т.д.
Примеры решения задач
| Задание | Какая масса метанола образуется при гидролизе метилацетата, массой 10 г? |
| Решение | Запишем уравнение гидролиза метилового эфира уксусной кислоты:
CH3— C(O)O- CH3 +H2O = CH3COOH + CH3OH. Определим количество вещества метилацетата, используя значение его массы из условия задачи (молярная масса – 84 г/моль): n = m/ M; n (CH3-C(O)O-CH3) = m (CH3-C(O)O-CH3)/ M (CH3-C(O)O-CH3) = 10/84 = 0,12 моль. По уравнению n (CH3— C(O)O- CH3) = n (CH3OH) =0,12 моль. Рассчитаем массу метанола (молярная масса – 32 г/моль): m= n× M; m(CH3OH)= n(CH3OH)× M(CH3OH) = 0,12×32 = 3,84 г. |
| Ответ | Масса метанола, образовавшегося в реакции равна 3,84 г. |
| Задание | Определите массу уксусной кислоты, которую можно получить в ходе реакции омыления этилацетата массой 180 г. |
| Решение | Запишем уравнение реакции гидролиза этилового эфира уксусной кислоты используя брутто формулы:
C4H8O2 + H2O ↔ CH3COOH + C2H5OH. Рассчитаем количество вещества этилацетата (молярная масса – 88 г/моль), используя значение массы из условий задачи: n = m/ M; n (C4H8O2) = m (C4H8O2)/ M (C4H8O2) = 180/88 = 2 моль. Согласно уравнению реакции, число моль этилацетата и уксусной кислоты равны: n (C4H8O2) = n (CH3COOH) = 2 моль. Тогда, можно определить массу уксусной кислоты (молярная масса – 60 г/моль): m(CH3COOH)= n (CH3COOH) × M (CH3COOH) = 2 × 60 = 120 г. |
| Ответ | Масса уксусной кислоты 120 грамм. |











