Пропан
Характеристики и физические свойства пропана
Пропан практически не растворим в воде, так как его молекулы малополярны и не взаимодействуют с молекулами воды. Он хорошо растворяется в неполярных органических растворителях, таких как бензол, тетрахлорметан, диэтиловый эфир и др.
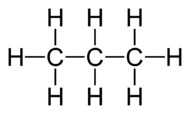
Рис. 1. Строение молекулы пропана.
Таблица 1. Физические свойства пропана.
|
Молекулярная формула |
C3H8 |
|
Молярная масса |
44 |
|
Плотность (20oС), кг/м3 |
1,8641 |
|
Температура плавления, oС |
-187,6 |
|
Температура кипения, oС |
-42,09 |
Получение пропана
Основными источниками пропана являются нефть и природный газ. Его можно выделить фракционной перегонкой природного газа или бензиновой фракции нефти.
В лабораторных условиях пропан получают следующими способами:
— гидрированием непредельных углеводородов
CH3-CH=CH2 + H2→CH3-CH2-CH3 (kat = Ni, to);
— восстановлением галогеналканов
C3H7I + HI →C3H8 + I2 (to);
— по реакции щелочного плавления солей одноосновных органических кислот
C3H7-COONa + NaOH → C3H8 + Na2CO3 (to);
— взаимодействием галогеналканов с металлическим натрием (реакция Вюрца)
C2H5Br + СH3Br + 2Na → CH3-CH2-CH3 + 2NaBr.
Химические свойства пропана
В обычных условиях пропан не реагирует с концентрированными кислотами, расплавленными и концентрированными щелочами, щелочными металлами, галогенами (кроме фтора), перманганатом калия и дихроматом калия в кислой среде.
Для пропана наиболее характерны реакции, протекающие по радикальному механизму. Энергетически более выгоден гомолитический разрыв связей C-H и C-C, чем их гетеролитический разрыв.
Все химические превращения пропана протекают с расщеплением:
- cвязей C-H
- галогенирование (SR)
CH3-CH2-CH3 + Br2→ CH3-CHBr-CH3 + HBr (hv).
- нитрование (SR)
CH3-CH2-CH3 + HONO2 (dilute)→ CH3-C(NO2)H-CH3 + H2O (to).
- сульфохлорирование (SR)
C3H8 + SO2 + Cl2→ C3H7-SO2Cl + HCl↑ (hv).
- дегидрирование
CH3-CH2-CH3→ CH2=CH-CH3 + H2 (kat = Ni, to).
- дегидроциклизация
CH3-CH2-CH3→ C3H6 + H2 (kat = Cr2O3, to).
- связей C-H и C-C
- окисление
C3H8 + 5O2→3CO2 + 4H2O (to).
Применение пропана
Пропан применяется как автомобильное топливо, а также используется в быту (баллонный газ).
Примеры решения задач
| Задание | Определите массу хлора, необходимого для хлорирования по первой стадии 5,2 л пропана. |
| Решение | Запишем уравнение реакции хлорирования пропана:
C3H8 + Cl2 = C3H7Cl + HCl. Найдем количество вещества пропана: n = V/ Vm; n(C3H8) = V(C3H8) / Vm; n(C3H8) = 5,2 / 22,4 = 0,23 моль. Согласно уравнению реакции n(C3H8) : n(Cl2) = 1:1, значит,количество моль хлора равно: n(Cl2) = n(C3H8) =0,23моль. Тогда, масса хлора будет равна (молярная масса – 71 г/моль): m(Cl2) = n(Cl2) × M(Cl2); m(Cl2) = n(Cl2) × M(Cl2); m(Cl2)=0,23 ×71= 16,33 г. |
| Ответ | Масса хлора равна 16,33 г. |
| Задание | Рассчитайте объемы хлора и пропана, приведенные к нормальным условиям, которые потребуются для получения 2,2-дихлорпропана массой 8,5 г. |
| Решение | Запишем уравнение реакции хлорирования пропана до 2,2-дихлорпропана (реакция происходит под действием УФ-излучения):
H3C-CH2-CH3 + 2Cl2 = H3C-CCl2-CH3 + 2HCl. Рассчитаем количество вещества 2,2-дихлорпропана (молярная масса равна – 113 г/моль): n = m / M; n(C3H6Cl2) = m (C3H6Cl2) / M (C3H6Cl2); n(C3H6Cl2) = 8,5 / 113 = 0,07 моль. Согласно уравнению реакции n(C3H6Cl2) : n(CH4) = 1:1, т.е. n(C3H6Cl2) = n(C3H8) = 0,07 моль. Тогда объем пропана будет равен: V = n × Vm; V(C3H8) = n(C3H8) × Vm; V(C3H8) = 0,07 × 22,4 = 1,568 л. По уравнению реакции найдем количество вещества хлора. n(C3H6Cl2) : n(Cl2) = 1:2, т.е. n(Cl2) = 2 × n(C3H6Cl2) = 2 × 0,07 = 0,14 моль. Тогда объем хлора будет равен: V = n × Vm; V(Cl2) = n(Cl2) × Vm; V(Cl2) = 0,14 × 22,4 = 3,136л. |
| Ответ | Объемы хлора и пропана равны 3,136 и 1,568 л соответственно. |











