Муравьиная кислота
Характеристики и физические свойства муравьиной кислоты
Смешивается с водой, диэтиловым эфиром, этанолом.
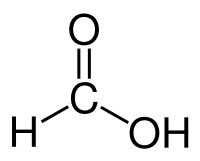
Рис. 1. Строение молекулы муравьиной кислоты.
Таблица 1. Физические свойства муравьиной кислоты.
|
Молекулярная формула |
H-COOH |
|
Молярная масса |
46 |
|
Плотность (20oС), г/см3 |
1,2196 |
|
Температура плавления, oС |
8,25 |
|
Температура кипения, oС |
100,7 |
Получение муравьиной кислоты
Основной способ получения муравьиной кислоты — окисление предельных метана (1), метилового спирта (2), формальдегида (метановый альдегид) (3):
CH4 + 3[O] → H-COOH + H2O (t = 150 – 200oC, p = 30 – 60 atm) (1);
CH3-OH + [O] → H-COOH (2);
H-C(O)H + [O] → HCOOH (3).
Химические свойства муравьиной кислоты
В водном растворе муравьиная кислота способна диссоциировать на ионы:
H-COOH↔H-COO— + H+.
Муравьиная кислота обладает химическими свойствами, характерными для растворов неорганических кислот, т.е. взаимодействует с металлами (1), их оксидами (2), гидроксидами (3) и слабыми солями (4):
2H-COOH + Zn → (HCOO)2Zn + H2↑ (1);
2H-COOH + CuO → (HCOO)2Cu + H2O (2);
H-COOH + KOH → H-COOK + H2O (3);
2H-COOH + NaHCO3→ HCOONa + H2O + CO2↑ (4).
При нагревании и в присутствии концентрированной серной кислоты муравьиная кислота взаимодействует со спиртами с образованием сложных эфиров:
H-COOH + C2H5OH ↔H-C(O)-O-C2H5 + H2O.
Применение муравьиной кислоты
Муравьиная кислота широко применяется для получения сложных эфиров, используемых в парфюмерии, в кожевенном деле (дубление кож), текстильной промышленности (как протрава при крашении), в качестве растворителя и консерванта.
Примеры решения задач
| Задание | При каталитическом гидрировании 35 г метаналя образовалась муравьиная кислота. Рассчитайте какая масса кислоты была получена. |
| Решение | Запишем уравнение реакции каталитического окисления метаналя:
H-C(O)H + [O] → HCOOH. Вычислим количество вещества метаналя (молярная масса равна 30 г/моль): n = m/ M; n(HCOH) = m(HCOH) / M(HCOH); n(HCOH) = 35 / 30 = 1,2 моль. Согласно уравнению реакции n(HCOH) : n(HCOOH) = 1:1, т.е. n(HCOOH) = n(HCOH) = 1,2 моль. Тогда масса муравьиной кислоты будет равна (молярная масса – 46 г/моль): m = n× M; m(HCOOH) =1,2 × 46 = 55,2 г. |
| Ответ | Масса муравьиной кислоты равна 55,2 г. |
| Задание | Муравьиную кислоту массой 5,40 г поместили в сосуд объемом 4,50 л и нагрели до температуры 200 °С. Давление паров при этом составило 43,7 кПа. Определите число молекул димера муравьиной кислоты в газовой фазе. |
| Решение | В парах муравьиная кислота находится частично в виде димеров, а частично в виде отдельных молекул:
2HCOOH → (HCOOH)2. Исходное количество муравьиной кислоты: n(HCOOH) = m(HCOOH)/ M(HCOOH) = 5,4 / 60 = 0,09 моль. Пусть в реакцию димеризации вступило х моль HCOOH, тогда образовалось х/2 моль димера (HCOOH)2и осталось (0,09 — х) моль HCOOH. Общее количество веществ в газовой фазе равно: n = PV / (RT) = 43,7 × 4,50 / (8,31 × 473) = 0,05 = х/2 + (0,09 – х), откуда х = 0,08 моль. Число молекул димера муравьиной кислоты в газовой фазе равно: N[(HCOOH)2] = n × NA = 0,08 / 2 × 6,02×1023 = 2,408×1022. |
| Ответ | 2,408×1022 молекул (HCOOH)2. |











