Крахмал
Характеристики и физические свойства крахмала
Его молекулы состоят из линейный и разветвленных цепей, содержащих остатки α-глюкозы. Фрагмент структуры крахмала выглядит следующим образом:
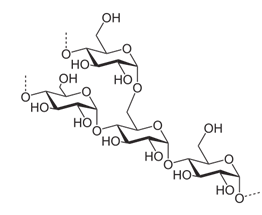
Крахмал является природным высокомолекулярным соединением и представляет собой смесь двух полисахаридов: амилозы и амилопектина. Число повторяющихся звеньев в различных молекулах амилозы и амилопектина варьируется от нескольких сотен до нескольких тысяч. Поэтому говорят только о средней молекулярной массе крахмала.
В горячей воде крахмальные зерна набухают и образуют коллоидный раствор, называемый крахмальным клейстером. Крахмал не обладает сладким вкусом.
Получение крахмала
В промышленности крахмал получают из картофеля (содержание крахмала – до 24%) или зерен кукурузы (57 – 72%).
Химические свойства крахмала
Крахмал способен гидролизоваться при нагревании в кислой среде, причем конечным продуктом гидролиза является глюкоза:
(С6Н10О5)n + nН2О → nC6H12O6.
Крахмал дает интенсивное синее окрашивание с йодом — это качественная реакция на йод.
Крахмал может образовывать эфиры за счет гидроксильных групп, однако они не имеют практического значения.
Применение крахмала
Крахмал – важнейшее пищевое вещество для человека и животных. В составе картофеля и зерновых культур (на крахмал приходится до 75% массы пшеничной муки) он потребляется в огромных количествах.
Примеры решения задач
| Задание | Массовая доля крахмала в картофеле равна 20%. Рассчитайте массу глюкозы, которую можно получить из 891 кг картофеля. Выход продукта реакции примите равным 50%. |
| Решение | Запишем уравнение гидролиза крахмала:
(C6H10O5)x + H2O (H+) → xC6H12O6. Массовая доля крахмала в составе состава НХ рассчитывается по следующей формуле: ω [(C6H10O5)n] = m [(C6H10O5)n] / m (potato) × 100%. Тогда масса крахмала в нем будет равна: m [(C6H10O5)n] = ω [(C6H10O5)n] / 100% × m (potato); m [(C6H10O5)n] = 20 / 100% × 891 = 0,2 × 891 = 178,2 кг. Рассчитаем количество вещества крахмала: n[(C6H10O5)n] = m [(C6H10O5)n] / M [(C6H10O5)n]; n[(C6H10O5)n] = 178,2 / 162x = 1,1x кмоль. Согласно уравнению реакции, количество вещества глюкозы будет равно: n[C6H12O6] = x × n[(C6H10O5)n] = x × 1,1x = 1,1x2кмоль. Теоретическая масса глюкозы рассчитывается как: mtheor(C6H12O6) = n[C6H12O6] × M(C6H12O6) = 1,1x2 × 180 = 198x2кг. Выход продукта реакции – это отношение его масс: η = mprac / mtheor × 100%. Найдем массу глюкозы, которую можно получить из 891 кг картофеля: mprac = η/100% × mtheor = 50/100 × 198x2 = 0,5 × 198x2 = 99x2кг. |
| Ответ | Масса глюкозы равна 99x2 кг |
| Задание | Из крахмала массой 8,1 г получена глюкоза, выход которой составил 70%. К глюкозе добавлен избыток аммиачного раствора оксида серебра. Рассчитайте массу серебра, образовавшегося при этом. |
| Решение | Запишем уравнение гидролиза крахмала:
(C6H10O5)x + H2O (H+) → xC6H12O6. Рассчитаем количество вещества крахмала: n[(C6H10O5)n] = m [(C6H10O5)n] / M [(C6H10O5)n]; n[(C6H10O5)n] = 8,1 / 162x = 0,05x моль. Согласно уравнению реакции, количество вещества глюкозы будет равно: n[C6H12O6] = x × n[(C6H10O5)n] = x × 0,05x = 0,05x2 моль. Теоретическая масса глюкозы рассчитывается как: mtheor(C6H12O6) = n[C6H12O6] × M(C6H12O6) = 0,05x2 × 180 = 9x2г. Выход продукта реакции – это отношение его масс: η = mprac / mtheor × 100%. Найдем массу глюкозы, которую можно получить из 8,1 г крахмала: mprac = η/100% × mtheor = 70/100 × 9x2 = 0,7 × 9x2 = 6,3x2г. Количество вещества глюкозы равно: nprac[C6H12O6] = mprac / M(C6H12O6) = 6,3x2 / 180 = 0,035x2 моль. Запишем уравнение взаимодействия глюкозы с аммиачным раствором оксида серебра: CH2OH-(CHOH)4-COH + Ag2O → CH2OH-(CHOH)4-COOH + 2Ag↓. Согласно уравнению реакции n(C6H12O6) :n(Ag) = 1:1, т.е. n(Ag) = n(C6H12O6) =0,035x2моль. Рассчитаем массу выделившегося серебра: m(Ag) = n(Ag) × M(Ag) = 0,035x2 × 108 = 3,78x2 г. |
| Ответ | Масса серебра равна 3,78x2 г |











