Гидроксид аммония
Общие сведения о гидроксида аммония
Аммиак очень хорошо растворяется в воде (при 20oС один объем воды растворяет около 700 объемов NH3). Хорошая растворимость объясняется образованием водородной связи между молекулами аммиака и воды. Поскольку молекула NH3 – лучший акцептор протона, чем H2O, то в растворе имеет место ионизация:

Появление ионов OH— создает щелочную среду раствора. Но, как это видно из значения константы основности
Kb = [NH4+]×[OH—] / [NH3×H2O] = 1,8×10-5, pKb = 4,76
реакция протекает в незначительной степени. В растворе с молярной концентрацией аммиака 1 моль/л ионизируется, например, всего лишь 0,4% молекул NH3 и H2O.
При взаимодействии ионов NH4+иOH— вновь образуются молекулы NH3 и H2O, между которыми имеет место водородная связь. Следовательно, ионное соединение NH4OH(гидроксид аммония) не существует, как не существуют гидроксид оксония OH3OH и дигидронитрид аммония NH4NH2.
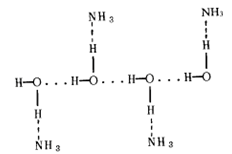
Из водных растворов аммиака выделяются два кристаллогидрата NH3×H2O и 2NH3×H2O, устойчивые лишь при низкой температуре. Молекулы аммиака и воды связаны в кристаллогидратах водородной связью. Так, NH3×H2O имеет структуру, в которой основой являются цепи из молекул воды, объединенных водородными связями. Цепи объединяются между собой в трехмерную решетку молекулами аммиака также посредством водородных связей:
Примеры решения задач
| Задание | Каковы масса и объем аммиака, которые потребуются для получения 5т нитрата аммония? |
| Решение | Запишем уравнение реакции получения нитрата аммония из аммиака и азотной кислоты:
NH3 + HNO3 = NH4NO3. Масса нитрата аммония, рассчитанная по уравнению будет равна: m(NH4NO3) = n(NH4NO3)×M(NH4NO3); n(NH4NO3) = 1моль; m(NH4NO3) = 1×80 = 80 т. Тогда, масса аммиака, рассчитанная по уравнению: m(NH3) = n (NH3)×M(NH3); n (NH3) = 1моль; m(NH3) = 1×17 = 17 т. Составим пропорцию и найдем истинную массу аммиака: xг NH3 – 5 т NH4NO3; 17 т NH3 – 80 т NH4NO3. x = 17 × 5 / 80 = 1,06, значит m(NH3) = 1,06 т. Найдем объем аммиака: 1,06 г NH3 – х л NH3; 17 т NH3 – 22,4×103 м3NH3. х = 22,4×103× 1,06 /17 = 1,4×103, значит V(NH3) = 1,4×103 м3. |
| Ответ | Масса аммиака — 1,06 т, объем аммиака — 1,4×103 м3. |
| Задание | Промышленному способу получения аммиака соответствует реакция:
а) NH4OH = NH3↑ +H2O; б) NH4Cl = NH3↑ +HCl↑; в) N2 + 3H2 ↔2NH3; г) NH4Cl + NaOH= NH3↑ + H2O + NaCl. |
| Ответ | Реакция «в» соответствует промышленному способу получения аммиака. |











