Аммоний
Характеристики и физические свойства аммония
Атом азота имеет на внешнем энергетическом уровне два спаренных и три неспаренных электрона:
7N 1s22s22p3
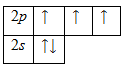
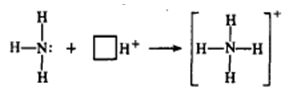
В молекуле аммиака неспаренные 2р-электроны атома азота образуют три электронные пары с электронами атомов водорода. У атома азота остается неподеленная пара электронов 2s2, т.е. два электрона с антипараллельными спинами на одной атомной орбитали. Атомная орбиталь иона водорода не содержит электронов (вакантная орбиталь). При сближении молекулы аммиака и иона водорода происходит взаимодействие неподеленной пары электронов атома азота и вакантной орбитали иона водорода, возникает химическая связь по донорно-акцептоному механизму. Атом азота молекулы аммиака является донором, а ион водорода – акцептором. Обозначив неподеленную пару электронов двумя точками, вакантную орбиталь квадратом, а связи черточками, можно представить образование иона аммония следующей схемой:
Качественные реакции на ион аммония
Чтобы обнаружить ион аммония в растворе можно использовать следующие реакции:
— действие сильных оснований (NaOH, KOH, Ca(OH)2 и пр.). аммонийные соли при нагревании с водным раствором сильных оснований разлагаются с выделением аммиака, который узнается по запаху. Кроме этого пары аммиака окрашивают в черный цвет бумагу, смоченную нитратом одновалентной ртути.
NH4Cl + NaOH→NaCl + NH3↑ + H2O.
— реакция с платинохлористоводородной кислотой, в результате которой образуется кристаллический осадок желтого цвета совершенно нерастворимый в концентрированном растворе хлористого аммония и в спирту.
H2[PtCl6] + 2NH4+→ (NH4)2[PtCl6]↓ + 2H+.
— действие винной кислоты, в результате чего образуется кислая соль виннокислый аммоний, представляющая собой осадок белого цвета
H2C4H4O6 + NH4+→ NH4HC4H4O6↓ + H+.
— нитрокобальти(III)ат натрия дает с ионом аммония желтый осадок
NH4+ + NO2—→ N2↑ + H2O.
— пикриновая кислота, вольфрамат натрия и фосфорномолибденовая кислота осаждают ионы аммония
— йодистый калий и гипохлорит натрия осаждают черный иодистый азот
2NH4+ + 2I— + 2ClO—→ NHI2↓ + NH3 + 2Cl— + 2H2O.
— р-нитродиазобензол в присутствии едкой щелочи дает с солями аммония красновато- желтый хлопьевидный осадок, причем раствор окрашивается в желтый или красный цвет
Примеры решения задач
| Задание | Аммиак объемом 20 л растворили в воде массой 400 г (объем газа приведен к нормальным условиям). Рассчитайте массовую долю аммиака в полученном водном растворе. |
| Решение | Массовая доля вещества Х в растворе рассчитывается по следующей формуле:
ω (Х) = m(X) / msolution × 100%.: Рассчитаем массу аммиака в растворе: n = V / Vm; n(NH3) = V(NH3) / Vm; n(NH3) = 20 / 22,4 = 0,9 моль. m = n × M; m(NH3) = n(NH3) × M(NH3); M(NH3) = Ar(N) + 3×Ar(H) = 14 + 3×1 = 17 г/моль. m(NH3) = 0,9 × 17 = 15,3 г. Масса раствора складывается из масс растворенного вещества и растворителя: msolution = m(H2O) + m(NH3) = 400 + 15,3 = 415,3 г. Тогда, массовая доля аммиака в растворе равна: ω (NH3) = m(NH3) / msolution × 100%; ω (NH3) = 15,3 / 415,3 × 100% = 3,68%. |
| Ответ | Массовая доля аммиака в растворе 3,68%. |
| Задание | Вычислите объем аммиака (нормальные условия), который должен прореагировать с хлороводородом, чтобы получился хлорид аммония массой 10,7 г. |
| Решение | Запишем уравнение реакции взаимодействия аммиака с хлороводородом:
NH3 + HCl = NH4Cl. Вычислим количество вещества хлорида аммония (молярная масса равна – 53,5 г/моль): n = m / M; n(NH4Cl) = m(NH4Cl) / M(NH4Cl); n(NH4Cl) = 10,7 / 53,5 = 0,2 моль. Согласно уравнению реакции n(NH4Cl) :n(NH3) = 1:1, т.е. n(NH3) = n(NH4Cl) = 0,2 моль. Найдем объем аммиака: V = Vm× n; V(NH3) = Vm× n(NH3); V(NH3) = 22,4 × 0,2 = 4,48 л. |
| Ответ | Объем аммиака равен 4,48 л. |











