Аммиак
Характеристики и физические свойства аммиака
Аммиак очень хорошо растворим в воде: 1 объем воды растворяет при комнатной температуре около 700 объемов аммиака. Концентрированный раствор содержит 25% NH3 (масс.) и имеет плотность 0,91 г/см3. Раствор аммиака в воде иногда называют нашатырным спиртом. С повышением температуры растворимость аммиака уменьшается.
При низкой температуре из раствора аммиака может быть выделен кристаллогидрат NH3×H2O, плавящийся при -79oС. Известен также кристаллогидрат состава 2NH3×H2O.
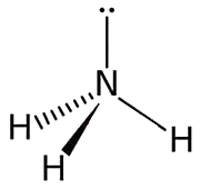
Рис. 1. Строение молекулы аммиака.
Таблица 1. Физические свойства аммиака.
|
Молекулярная формула |
NH3 |
|
Молярная масса, г/моль |
17 |
|
Плотность, г/см3 |
0,6826 |
|
Температура плавления, oС |
195,42 |
|
Температура кипения, oС |
239,74 |
|
Растворимость в воде (0oС), г/100мл |
89,9 |
Получение аммиака
В лаборатории аммиак обычно получают6 нагревая хлорид аммония с гашеной известью:
2NH4Cl + Ca(OH)2 = CaCl2 + 2H2O + 2NH3↑.
Выделяющийся аммиак содержит пары воды. Для осушения его пропускают через натронную известь (смесь извести с едким натром).
Химические свойства аммиака
В химическом отношении аммиак довольно активен; он вступает во взаимодействие со многими веществами.
Если пропускать ток NH3 по трубке, вставленной в другую широкую трубку, по которой проходит кислород, то аммиак можно легко зажечь; он горит зеленоватым пламенем. При горении аммиака образуется вода и свободный азот:
4NH3 + 3O2 = 6H2O + 2N2.
При других условиях аммиак может окисляться до оксида азота NO.
При замещении в молекулах аммиака только одного атома водорода металлами образуются амиды металлов. Так, пропуская аммиак над расплавленным натрием, можно получить амид натрия NaNH2 в виде бесцветных кристаллов:
2Na + 3NH3 = 2NaNH2 + H2.
Аммиак реагирует с кислотами, находящимися в свободном состоянии или в растворе, нейтрализуя их и образуя соли аммония. Например, с соляной кислотой получается хлорид аммония NH4Cl:
NH3 + HCl = NH4Cl.
Взаимодействие аммиака с водой тоже приводит к образованию не только гидратов аммиака, но частично и иона аммония:
NH3 + H2O ↔ NH4+ + OH—.
Применение аммиака
Аммиак – одно из важнейших соединений азота: в больших количествах он расходуется в производстве азотных удобрений, взрывчатых веществ, полимеров, азотной кислоты и соды, используется в качестве холодильного агента в морозильных установках, а также в медицине.
Примеры решения задач
| Задание | Чему равна константа кислотности иона аммония? |
| Решение | Реакцию диссоциации кислоты NH4+ в воде
NH4+ + H2O↔H3O+ + NH3 характеризует Ka(NH4+) = Kw / Kb (NH3). Значения Kw и Kb равны 1,0×10-14 и 1,76×10-5 соответственно. Ka(NH4+) = 1,0×10-14 / 1,76×10-5 = 5,68×10-10. |
| Ответ | Константа кислотности иона аммония равна 5,68×10-10 |
| Задание | Рассчитайте рН 0,1М раствора аммиака. |
| Решение | Степень диссоциации аммиака в 1.0×10-1М водном растворе меньше 5% (по табличным данным h = 1,3%). Следовательно,
[NH3] ≈c(NH3) = 1.0×10-1М; [H+] = Kw / Kb×c(NH3). Значения Kw и Kb равны 1,0×10-14 и 1,76×10-5 соответственно. Тогда, [H+] = 1,0×10-14 / 1,76×10-5× 1.0×10-1 = 7,52×10-12; pH = 11,12. |
| Ответ | рН раствора аммиака равен 11,12 |











