Алканы
Характеристики и физические свойства алканов
В обычных условиях (при 25oС и атмосферном давлении) первые четыре члена гомологического ряда алканов (C1 — C4) – газы. Нормальные алканы от пентана до гептадекана (С5 – С17) – жидкости, начиная с С18 и выше – твердые вещества. По мере увеличения относительной молекулярной массы, возрастают температуры кипения и плавления алканов. При одинаковом числе атомов углерода в молекуле алканы с разветвленным строением имеют более низкие температуры кипения, чем нормальные алканы. Строение молекулы алканов на примере метана приведено на рис. 1.
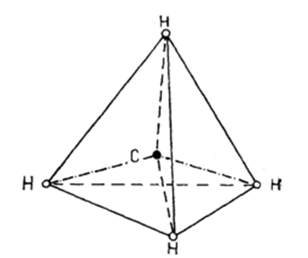
Рис. 1. Строение молекулы метана.
Алканы практически не растворимы в воде, так как их молекулы малополярны и не взаимодействуют с молекулами воды. Жидкие алканы легко смешиваются друг с другом. Они хорошо растворяются в неполярных органических растворителях, таких как бензол, тетрахлорметан, диэтиловый эфир и др.
Получение алканов
Основные источники различных предельных углеводородов, содержащих до 40 атомов углерода, — нефть и природный газ. Алканы с небольшим числом атомов углерода (1 – 10) можно выделить фракционной перегонкой природного газа или бензиновой фракции нефти.
Различают промышленные (I) и лабораторные (II) способы получения алканов.
I.
C + H2→ CH4 (kat = Ni, t0);
CO + 3H2→ CH4 + H2O (kat = Ni, t0 = 200 – 300);
CO2 + 4H2→ CH4 + 2H2O (kat, t0).
II.
— гидрирование непредельных углеводородов
CH3-CH=CH2 + H2→CH3-CH2-CH3 (kat = Ni, t0);
— восстановление галогеналканов
C2H5I + HI →C2H6 + I2 (t0);
— реакции щелочного плавления солей одноосновных органических кислот
C2H5-COONa + NaOH→ C2H6 + Na2CO3 (t0);
— взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
2C2H5Br + 2Na → CH3-CH2-CH2-CH3 + 2NaBr;
— электролиз солей одноосновных органических кислот
2C2H5COONa + 2H2O→H2↑ + 2NaOH + C4H10↑ + 2CO2↑;
К(-): 2H2O + 2e → H2 + 2OH—;
A(+):2C2H5COO— -2e → 2C2H5COO+→ 2C2H5+ + 2CO2.
Химические свойства алканов
Алканы относятся к наименее реакционноспособным органическим соединениям, что объясняется их строением.
Алканы в обычных условиях не реагируют с концентрированными кислотами, расплавленными и концентрированными щелочами, щелочными металлами, галогенами (кроме фтора), перманганатом калия и дихроматом калия в кислой среде.
Для алканов наиболее характерны реакции, протекающие по радикальному механизму. Энергетически более выгоден гомолитический разрыв связей C-H и C-C, чем их гетеролитический разрыв.
Реакции радикального замещения наиболее легко протекают по третичному, дплее – по вторичному и в последнюю очередь по первичному атому углерода.
Все химические превращения алканов протекают с расщеплением:
1) cвязей C-H
— галогенирование (SR)
CH4 + Cl2→ CH3Cl + HCl (hv);
CH3-CH2-CH3 + Br2→ CH3-CHBr-CH3 + HBr (hv).
— нитрование (SR)
CH3-C(CH3)H-CH3 + HONO2 (dilute)→ CH3-C(NO2)H-CH3 + H2O (t0).
— сульфохлорирование (SR)
R-H + SO2 + Cl2→ RSO2Cl + HCl↑ (hv).
— дегидрирование
CH3-CH3→ CH2=CH2 + H2 (kat = Ni, t0).
— дегидроциклизация
CH3(CH2)4CH3→ C6H6 + 4H2 (kat = Cr2O3, t0).
2) связей C-H и C-C
— изомеризация (внутримолекулярная перегруппировка)
CH3-CH2-CH2-CH3→CH3-C(CH3)H-CH3 (kat=AlCl3, t0).
— окисление
2CH3-CH2-CH2-CH3 + 5O2→ 4CH3COOH + 2H2O (t0, p);
CnH2n+2 + (1,5n + 0,5)O2→ nCO2 + (n+1) H2O (t0).
Применение алканов
Алканы нашли применение в различных отраслях промышленности. Рассмотрим подробнее, на примере некоторых представителей гомологического ряда, а также смесей алканов.
Метан составляет сырьевую основу важнейших химических промышленных процессов получения углерода и водорода, ацетилена, кислородсодержащих органических соединений – спиртов, альдегидов, кислот. Пропан применяется как автомобильное топливо. Бутан используется для получения бутадиена, являющегося сырьем для производства синтетического каучука.
Смесь жидких и твердых алканов до С25, называемая вазелином применяется в медицине как основа мазей. Смесь твердых алканов С18 – С25 (парафин) применяется для пропитки различных материалов (бумага, ткани, древесина) для придания им гидрофобных свойств, т.е. несмачиваемости водой. В медицине используется для физиотерапевтическихпроцедур (парафинолечение).
Примеры решения задач
| Задание | При хлорировании метана получено 1,54 г соединения, плотность паров по воздуху которого равна 5,31. Рассчитайте массу диоксида марганца MnO2, которая потребуется для получения хлора, если соотношение объемов метана и хлора, введенных в реакцию равно 1:2. |
| Решение | Отношение массы данного газа к массе другого газа, взятого в том же объеме, при той же температуре и том же давлении, называется относительной плотностью первого газа по второму. Данная величина показывает, во сколько раз первый газ тяжелее или легче второго газа.
D = M1 / M2. Относительную молекулярную массу воздуха принимают равной 29 (с учетом содержания в воздухе азота, кислорода и других газов). Следует отметить, что понятие «относительная молекулярная масса воздуха» употребляется условно, так как воздух – это смесь газов. Найдем молярную массу газа, образующегося при хлорировании метана: Mgas = 29 ×Dair(gas) = 29 × 5,31 = 154 г/моль. Это тетрахлорметан – CCl4. Запишем уравнение реакции и расставим стехиометрические коэффициенты: CH4 + 4Cl2 = CCl4 + 4HCl. Рассчитаем количество вещества тетрахлорметана: n = m / M; n(CCl4) = m(CCl4) / M(CCl4); n(CCl4) = 1,54 / 154 = 0,01 моль. Согласно уравнению реакции n(CCl4) : n(CH4) = 1 : 1, значит n(CH4) = n(CCl4) = 0,01 моль. Тогда, количество вещества хлора должно быть равно n(Cl2) = 2 × 4 n(CH4), т.е. n(Cl2) = 8 × 0,01 = 0,08 моль. Запишем уравнение реакции получения хлора: MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O. Число моль диоксида марганца равно 0,08 моль, т.к. n(Cl2) :n(MnO2) = 1 : 1. Найдем массу диоксида марганца: m = n×M; m(MnO2) = n(MnO2) ×M(MnO2); M(MnO2) = Ar(Mn) + 2×Ar(O) = 55 + 2×16 = 87 г/моль; m(MnO2) = 0,08 × 87 = 10,4 г. |
| Ответ | Масса диоксида марганца равна 10,4 г. |
| Задание | Установите молекулярную формулу трихлоралкана, массовая доля хлора в котором составляет 72,20%. Составьте структурные формулы всех возможных изомеров и дайте названия веществ по заместительной номенклатуре ИЮПАК. |
| Ответ | Запишем общую формулу трихлоралкеана:
CnH2n-1Cl3. По формуле ω(Cl) = 3×Ar(Cl) / Mr(CnH2n-1Cl3) × 100% рассчитаем молекулярную массу трихлоралкана: Mr(CnH2n-1Cl3) = 3 × 35,5 / 72,20 × 100% = 147,5. Найдем значение n: 12n + 2n – 1 + 35,5×3 = 147,5; n = 3. Следовательно, формула трихлоралкана C3H5Cl3. Составим структурные формулы изомеров: 1,2,3-трихлорпропан (1), 1,1,2-трихлорпропан (2), 1,1,3-трихлорпропан (3), 1,1,1-трихлорпропан (4) и 1,2,2-трихлорпропан (5). CH2Cl-CHCl-CH2Cl (1); CHCl2-CHCl-CH3 (2); CHCl2-CH2-CH2Cl (3); CCl3-CH2-CH3 (4); CH2Cl-CCl2-CH3 (5). |











