Ацетилен
Характеристики и физические свойства ацетилена
Мало растворим в воде и очень хорошо в ацетоне. В виде ацетонового раствора его хранят в стальных баллонах, заполненных каким-нибудь инертным пористым материалом. Смеси ацетилена с воздухом взрывоопасны.
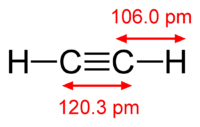
Рис. 1. Строение молекулы ацетилена.
Таблица 1. Физические свойства ацетилена.
|
Молекулярная формула |
СH≡CH (C2H2) |
|
Молярная масса, г/моль |
26 |
|
Плотность, г/л |
1,0896 |
|
Температура плавления, oС |
-80,8 |
|
Температура кипения, oС |
-83,6 |
Получение ацетилена
Выделяют промышленные и лабораторные способы получения ацетилена. Так, в промышленности ацетилен получают путем высокотемпературного крекинга метана:
2CH4→ СH≡CH +3H2.
В лаборатории ацетилен получают гидролизом карбида кальция:
CaC2 +2H2O = Ca(OH)2 + C2H2.
Кроме вышеперечисленных реакций, для получения ацетилена используют реакции дегидрирования алканов и алкенов:
CH3-CH3→ СH≡CH +2H2;
CH2=CH2→ СH≡CH +H2.
Химические свойства ацетилена
Ацетилен вступает в реакции присоединения, протекающие по нуклеофильному механизму, такие как:
— гидрирование
СH≡CH +H2O→ [CH2=CH-OH] → CH3-CH=O (H2SO4 (18%), t = 90oC);
— галогенирование
СH≡CH +Br2→CHBr=CHBr + Br2 →CHBr2-CHBr2;
— гидрогалогенирование
СH≡CH +HСl→ CH2=CHCl + HCl → CH3-CHCl2.
Кроме этого ацетилен способен образовывать соли при взаимодействии с активными металлами (1) и оксидом серебра (2):
2СH≡CH +2Na→2 СH≡C-Na + H2 (1);
СH≡CH + Ag2O→ Ag- С≡C-Ag↓ + H2O (2).
Он способен тримеризоваться:
3C2H2→ C6H6 (t = 600oC, kat = Cactive).
Применение ацетилена
Ацетилен является исходным продуктом для многих важнейших химических производств. Например, из ацетилена получают различные галогенпроизводные, такие как тетрахлорэтан и трихлорэтилен, являющиеся хорошими растворителями, а также винилхлорид, служащий мономером для получения поливинилхлорида. Кроме этого ацетилен используется для получения синтетических каучуков.
Примеры решения задач
| Задание | Эквимолекулярная смесь ацетилена и формальдегида полностью реагирует с 69,6 г Ag2O, растворенного в аммиаке. Определите состав исходной смеси. |
| Решение | Запишем уравнения реакций, указанных в условии задачи:
HC≡CH + Ag2O → AgC≡Cag + H2O (1); H-C(O)H + 2 Ag2O → CO2 + H2O + 4Ag (2). Рассчитаем количество вещества оксида серебра (I): n = m / M; n(Ag2O) = m(Ag2O) / M(Ag2O); M(Ag2O) = 232 г/моль; n(Ag2O) = 69,6 / 232 = 0,3 моль. По уравнению (2) количество вещества формальдегида будет равно 0,1 моль. По условию задачи смесь эквимолекулярна, следовательно, ацетилена тоже будет 0,1 моль. Найдем массы веществ, составляющих смесь: M(HC≡CH) = 26 г/моль; M(H-C(O)H) = 30 г/моль; m(HC≡CH) = 0,1 × 26 = 2,6 г; m(H-C(O)H) = 0,1 × 30 = 3 г. |
| Ответ | Масса ацетилена равна 2,6 г, формальдегида – 3 г. |
| Задание | При пропускании смеси пропана и ацетилена через склянку с бромной водой масса склянки увеличилась на 1,3 г. При полном сгорании такого же количества исходной смеси углеводородов выделилось 14 л (н.у.) оксида углерода (IV). Определите массовую долю пропана в исходной смеси. |
| Решение | При пропускании смеси пропана и ацетилена через склянку с бромной водой происходит поглощение ацетилена. Запишем уравнение химической реакции, соответствующее этому процессу:
НC ≡ СH + 2Вr2 → НСВr2 -СНВr2. Таким образом, значение, на которое увеличилась масса склянки (1,3 г) представляет собой массу ацетилена. Найдем количество вещества ацетилена (молярная масса – 26 г/моль): n = m / M; n (C2H2) = m (C2H2) / M (C2H2); n (C2H2) = 1,3/26 = 0,05 моль. Запишем уравнение реакции сгоранияацетилена: 2С2Н2 + 5О2 = 4СО2 + 2Н2О. Согласно уравнению реакции, в неё вступило 2 моль ацетилена, однако, известно, что 0,05 моль из этого количества поглотилось бромной водой. Т.е. выделилось: 2-0,05 = 0,1 моль СО2. Найдем общее количество оксида углерода (IV): n = V / Vm; nsum(CO2) = V (CO2) / Vm; nsum(CO2) = 14/22,4 = 0,625 моль. Запишем уравнение реакции сгорания пропана: С3Н8 + 5О2 = 3СO2 + 4Н2О. Учитывая, что в реакции сгорания ацетилена выделилось 0,1 моль оксида углерода (IV), количество вещества оксида углерода (IV), выделившееся в ходе сгорания пропана равно: 0,625 — 0,1 = 0,525 моль СО2. Найдем количество вещества пропана, вступившего в реакцию горения. Согласно уравнению реакции n(CO2) : n(С3Н8) = 3 : 1, т.е. n(С3Н8) = n(CO2) / 3 = 0,525/3 = 0,175 моль. Вычислим массу пропана (молярная масса 44 г/моль): m = n ×M; m(С3Н8) = n(С3Н8) ×M(С3Н8); m(С3Н8) = 0,175 × 44 = 7,7 г. Тогда, общая масса смеси углеводородов составит: mmixture = m(C2H2) + m(С3Н8) = 1,3+7,7 = 9,0 г. Найдем массовую долю пропана в смеси: ω = m / mmixture× 100%; ω(С3Н8) = m(С3Н8) / mmixture× 100%; ω(С3Н8) =7,7/9,0× 100% = 0,856 × 100%= 85,6%. |
| Ответ | Массовая доля пропана 85,6%. |











