Плотность жидкого азота
Плотность жидкого азота и другие его физические свойства
В твердом состоянии представляет собой кристаллы белого цвета.
Азот плохо растворяется в воде (хуже, чем кислород), но при этом хорошо растворяется в жидком диоксиде серы.
Химический состав и строение молекулы жидкого азота
При обычных условиях азот – бесцветный газ, состоящий из молекул N2. Между атомами азота в молекуле есть тройная связь, вследствие чего его молекула исключительно прочная. Молекулярный азот химически малоактивен, слабо поляризуется.
Рассмотрим образование молекулы азота (рис. 1), электронное облако которого имеет форму вытянутой восьмерки. При приближении двух атомов азота их электронные облака перекрываются. Такое перекрывание возможно лишь тогда, когда электроны имеют антипараллельные спины. В области перекрывания облаков повышается электронная плотность, вследствие чего возрастают силы притяжения между атомами. Число общих электронных пар в молекуле азота равно единице (по одному электрону от каждого атома). В молекуле реализуется ковалентный (неполярная) тип связи.
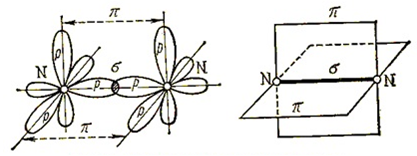
Рис. 1. Строение молекулы азота.
Краткое описание химических свойств и плотность жидкого азота
В обычных условиях азот — химически пассивный элемент; не реагирует с кислотами, щелочами, гидратом аммиака, галогенами, серой. В незначительной степени реагирует с водородом и кислородом при действии электрического разряда (1, 2). В присутствии влаги реагирует с литием при комнатной температуре (3). При нагревании реагирует с магнием, кальцием, алюминием и другими металлами (4, 5, 6).
N2 + 3H2↔ 2NH3 (1);
N2 + O2↔ 2NO (2);
N2 + 6Li = 2Li3N (3);
N2 + 3Mg = Mg3N_2 (4);
N2 + 3Ca = Ca3N2 (5);
N2 + 2Al = 2AlN (6).
Реакции взаимодействия азота с фтором и углеродом также, как и в случае водорода или кислорода, протекают при действии электрического разряда:
N2 + 3F2 = 2NF3;
N2 + 2C↔C2N2.
При нагревании до температуры 500-600oC азот реагирует с гидридом лития (7), если же температурный диапазон составляет 300-350oC, то возможна реакция с карбидом кальция (8):
N2 + 3LiH = Li3N + NH3 (7);
N2 + CaC2 = Ca(CN)2 (8).
Примеры решения задач
| Задание | Плотность газа по воздуху равна 2,564. Рассчитайте массу газа объемом 1 л (н.у.). |
| Решение | Отношение массы данного газа к массе другого газа, взятого в том же объеме, при той же температуре и том же давлении, называется относительной плотностью первого газа по второму. Данная величина показывает, во сколько раз первый газ тяжелее или легче второго газа.
D = M1 / M2. Молярная масса газа равна его плотности по отношению к другому газу, умноженной на молярную массу второго газа: M1 = D×M2. Относительную молекулярную массу воздуха принимают равной 29 (с учетом содержания в воздухе азота, кислорода и других газов). Следует отметить, что понятие «относительная молекулярная масса воздуха» употребляется условно, так как воздух – это смесь газов. Тогда, молярная масса газа будет равна: Mgas = Dair× M(air) = 2,564 × 29 = 74,356г/моль. Массу газа можно рассчитать по формуле: m(gas) = n(gas) ×Mgas. Найдем количество вещества газа: V(gas) = n(gas) ×Vm; n(gas) = V(gas) / Vm = 1 / 22,4 = 0,04 моль. Тогда, m(gas) = 0,04 ×74,356 = 2,97 г. |
| Ответ | Масса газа равна 2,97 г. |
| Задание | Образец газа массой 1,436 г занимает при нормальных условиях объем, равный 0,5 л. Рассчитайте молярную массу газа. |
| Решение | Массу газа можно рассчитать по формуле:
m(gas) = n(gas) ×Mgas. Найдем количество вещества газа: V(gas) = n(gas) ×Vm; n(gas) = V(gas) / Vm = 0,5 / 22,4 = 0,02 моль. Тогда, молярная масса газа будет равна: Mgas = m(gas) / n(gas) = 1,436 / 0,02 = 71,8 г/моль. |
| Ответ | Молярная масса газа равна 71,8 г/моль. |











