Плотность углекислого газа
Плотность углекислого газа и другие его физические свойства
Он плохо растворяется в воде, частично реагируя с ней.
Основные константы углекислого газа приведены в таблице ниже.
Таблица 1. Физические свойства и плотность углекислого газа.
|
Плотность, кг/м3 |
1,9768 |
|
Удельная теплота плавления, кДж/моль |
25,13 |
|
Динамическая вязкость, Па×с |
8,5×10-5 |
|
Молярная масса, г/моль |
44,01 |
Углекислый газ играет важную роль в биологических (фотосинтез), природных (парниковый эффект) и геохимических (растворение в океанах и образование карбонатов) процессах. В больших количествах он поступает в окружающую среду в результате сжигания органического топлива, гниения отходов и др.
Химический состав и строение молекулы углекислого газа
Химический состав молекулы углекислого газа выражается эмпирической формулой CO2. Молекула диоксида углерода (рис. 1) линейная, что соответствует минимальному отталкиванию связывающих электронных пар, длина связи С=Щ равна 0,116 нм, а её средняя энергия – 806 кДж/моль. В рамках метода валентных связей две σ-связи С-О образованы sp-гибридизованнойорбиталью атома углерода и 2pz – орбиталями атомов кислорода. Не участвующие в sp-гибридизации 2px— и 2py-орбитали атома углерода перекрываются с аналогичными орбиталями атомов кислорода. При этом образуются две π-орбитали, расположенные во взаимно перпендикулярных плоскостях.
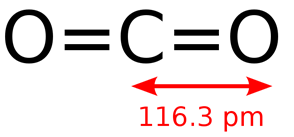
Рис. 1. Строение молекулы углекислого газа.
Благодаря симметричному расположению атомов кислорода молекула CO2 неполярная, поэтому диоксид мало растворим в воде (один объем CO2 в одном объеме H2O при 1 атм и 15oС). Неполярность молекулы приводит к слабым межмолекулярным взаимодействия и низкой температуре тройной точки: t = -57,2oС и P = 5,2 атм.
Краткое описание химических свойств и плотность углекислого газа
Химически углекислый газ инертен, что обусловлено высокой энергией связей O=C=O. С сильными восстановителями при высоких температурах диоксид углерода проявляет окислительные свойства. Углем он восстанавливается до угарного газа CO:
C + CO2 = 2CO (t = 1000oC).
Магний, зажженный на воздухе, продолжает гореть и в атмосфре углекислого газа:
CO2 + 2Mg = 2MgO + C.
Оксид углерода (IV) частично реагирует с водой:
CO2(l) + H2O = CO2×H2O(l) ↔ H2CO3(l).
Проявляет кислотные свойства:
CO2 + NaOHdilute = NaHCO2;
CO2 + 2NaOHconc = Na2CO3 + H2O;
CO2 + Ba(OH)2 = BaCO3↓ + H2O;
CO2 + BaCO3(s) + H2O = Ba(HCO3)2(l).
При нагревании до температуры свыше 2000oС углекислый раз разлагается:
2CO2 = 2CO + O2.
Примеры решения задач
| Задание | При сгорании 0,77 г органического вещества, состоящего из углерода, водорода и кислорода, образовалось 2,4 г углекислого газа и 0,7 г воды. Плотность паров вещества по кислороду равна 1,34. Определите молекулярную формулу вещества. |
| Решение | Составим схему реакции сгорания органического соединения обозначив количество атомов углерода, водорода и кислорода за «x», «у» и «z» соответственно:
CxHyOz + Oz →CO2 + H2O. Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м. m(C) = n(C)×M(C) = n(CO2)×M(C) = [m(CO2) / M(CO2)]×M(C); m(H) = n(H)×M(H) = 2×n(H2O)×M(H) = [2×m(H2O) / M(H2O)] ×M(H); Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль; M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль. Тогда, m(C) = [2,4 / 44]×12 = 0,65 г; m(H) = 2×0,7 / 18 ×1= 0,08 г. m(O) = m(CxHyOz) – m(C) – m(H) = 0,77 – 0,65– 0,08 = 0,04 г. Определим химическую формулу соединения: x:y:z = m(C)/Ar(C) : m(H)/Ar(H) : m(O)/Ar(O); x:y:z = 0,65/12 :0,08/1 : 0,04/16; x:y:z = 0,054: 0,08: 0,0025 = 22 : 32 : 1. Значит простейшая формула соединения C22H32O, а его молярная масса равна 46 г/моль [M(C22H32O) = 22×Ar(C) + 32×Ar(H) + Ar(O)= 22×12 + 32×1 + 16 = 264 + 32 + 16 = 312 г / моль]. Значение молярной массы органического вещества можно определить при помощи его плотности по кислороду: Msubstance = M(O2) × D(O2); Msubstance = 32 × 1,34 = 43 г/моль. Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс: Msubstance / M(C22H32O) = 43 / 312 = 0,13. Значит все коэффициенты в формуле необходимо умножить на 0,13. Значит молекулярная формула вещества будет иметь вид C3H4O. |
| Ответ | Молекулярная формула вещества C3H4O |
| Задание | При сжигании органического вещества массой 10,5 г получили 16,8 л углекислого газ (н.у.) и 13,5 г воды. Плотность паров вещества по воздуху равна 2,9. Выведите молекулярную формулу вещества. |
| Решение | Составим схему реакции сгорания органического соединения обозначив количество атомов углерода, водорода и кислорода за «x», «у» и «z» соответственно:
CxHyOz + Oz →CO2 + H2O. Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м. m(C) = n(C)×M(C) = n(CO2)×M(C) = [V(CO2) / Vm)]×M(C); m(H) = n(H)×M(H) = 2×n(H2O)×M(H) = [2×m(H2O) / M(H2O)] ×M(H); Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль; M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль. Тогда, m(C) = [16,8 / 22,4]×12 = 9 г; m(H) = 2×13,5 / 18 ×1= 1,5 г. m(O) = m(CxHyOz) – m(C) – m(H) = 10,5 – 9 – 1,5 = 0 г. Определим химическую формулу соединения: x:y = m(C)/Ar(C) : m(H)/Ar(H); x:y = 9/12 : 1,5/1; x:y = 0,75: 1,5 = 1 : 2. Значит простейшая формула соединения CH2, а его молярная масса равна 14 г/моль [M(CH2) = Ar(C) + 2×Ar(H) = 12 + 2×1 = 12 + 2 = 14 / моль]. Значение молярной массы органического вещества можно определить при помощи его плотности по воздуху: Msubstance = M(air) × D(air); Msubstance = 29 × 2,9 = 84 г/моль. Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс: Msubstance / M(CH2) = 84 / 14 = 6. Значит индексы атомов углерода и водорода должны быть в 6 раз выше, т.е. формула вещества будет иметь вид C6H12. |
| Ответ | Молекулярная формула вещества C6H12 |











