Плотность серы
Плотность серы и другие её физические свойства
Обычная модификация твердой серы в узлах кристаллической структуры содержит молекулы S8. Она образует две кристаллические модификации, существующие при температуре, близкой к комнатной. Это так называемые ромбическая и моноклинная (или, что то же, моноклиническая, призматическая) сера. Иначе их называют a- и b- формой соответственно. Точка перехода ромбической серы в моноклинную лежит при 95oС. Хотя a- и b-формы серы имеют один и тот же молекулярный состав, они, кристаллизуясь, образуют различные кристаллические структуры.
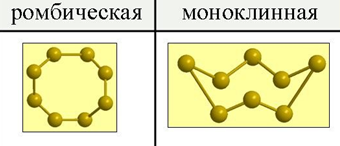
Рис. 1. Аллотропные модификации серы.
Важнейшие константы серы представлены в таблице ниже:
Таблица 1. Физические свойства и плотность серы.
|
Характеристика |
Ромбическая сера |
Моноклинная сера |
|
Цвет |
светло-желтый порошок |
Желтые иглы |
|
Плотность, г/см3 |
2,07 |
1,98 |
|
Температура плавления, oС |
112,8 |
119,3 |
|
Температура кипения, oС |
444,6 |
|
Распространенность серы в природе
Сера встречается в природе как в свободном состоянии (самородная сера), так и в различных соединениях. Очень распространены соединения серы с различными металлами. Многие из них являются ценными рудами (например, свинцовый блеск PbS, цинковая обманка ZnS, медный блеск Cu2S) и служат источником получения цветных металлов.
Из соединений серы в природе также распространены сульфаты, главным образом, кальция и магния; соединения серы содержатся в организмах растений и животных.
Общее содержание серы земной коре составляет приблизительно 0,1%.
Краткая характеристика химических свойств и плотность серы
Сера охотно (в сравнительно мягких условиях) взаимодействует со многими металлами и неметаллами. Примером может служит её реакция с металлической медью:
Cu + S = CuS + Q.
С другими металлами, например с железом и цинком, сера реагирует менее энергично. С неметаллами сера также активно взаимодействует. Например, пропускание паров серы над углеродом приводит к образованию сероуглерода CS2 (жидкость при обычных условиях). Взаимодействуя при комнатной температуре с фтором, сера загорается, образуя шестифтористую серу SF6, которая имеет практическое значение как газообразный диэлектрик и источник атомарного фтора.
S + H2 = H2S;
S + O2 = SO2;
S + 3F2 = SF6;
S + Cl2 = SCl2;
2S + C = CS2.
Сера не реагирует с жидкой водой, иодом. Окисляется концентрированными серной и азотной кислотами, подвергается дисмутации в растворах щелочей и гидрата аммиака.
S + 2H2SO4(conc) = 3SO2 + 2H2O;
S + 6HNO3(conc) = H2SO4 + 6NO2 + 2H2O;
4S + 6NaOH(conc) = Na2SO3S + 2Na2S + 3H2O.
Примеры решения задач
| Задание | При полном сгорании кислородсодержащего органического вещества массой 13,8 г получили 26,4 г углекислого газа и 16,2 г воды. Найдите молекулярную формулу вещества, если относительная плотность его паров по водороду равна 23. |
| Решение | Составим схему реакции сгорания органического соединения обозначив количество атомов углерода, водорода и кислорода за «x», «у» и «z» соответственно:
CxHyOz + Oz →CO2 + H2O. Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м. m(C) = n(C)×M(C) = n(CO2)×M(C) = [m(CO2) / M(CO2)]×M(C); m(H) = n(H)×M(H) = 2×n(H2O)×M(H) = [2×m(H2O) / M(H2O)] ×M(H); Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль; M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль. Тогда, m(C) = [26,4 / 44]×12 = 7,2 г; m(H) = 2×16,2 / 18 ×1= 1,8 г. m(O) = m(CxHyOz) – m(C) – m(H) = 13,8 – 7,2 – 1,8 = 4,8 г. Определим химическую формулу соединения: x:y:z = m(C)/Ar(C) : m(H)/Ar(H) : m(O)/Ar(O); x:y:z = 7,2/12 :1,8/1 :4,8/16; x:y:z = 0,6 : 1,8 : 0,3 = 2: 6 : 1. Значит простейшая формула соединения C2H6O и молярную массу 46 г/моль [M(C2H6O) = 2×Ar(C) + 6×Ar(H) + Ar(O) = 2×12 + 6×1 + 16 = 24 + 6 + 16 = 46 / моль]. Значение молярной массы органического вещества можно определить при помощи его плотности по водороду: Msubstance = M(H2) × D(H2); Msubstance = 2 × 23 = 46 г/моль. Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс: Msubstance / M(C2H6O) = 46 / 46 = 1. Значит формула органического соединения будет иметь вид C2H6O. |
| Ответ | C2H6O |
| Задание | При сгорании 7 г органического вещества получили 11,2 л (н.у.) CO2 и 9 г H2O. Относительная плотность вещества по кислороду равна 1,313. Найдите молекулярную формулу вещества. |
| Решение | Составим схему реакции сгорания органического соединения обозначив количество атомов углерода, водорода и кислорода за «x», «у» и «z» соответственно:
CxHyOz →CO2 + H2O. Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м. m(C) = n(C)×M(C) = n(CO2)×M(CO2) = [V(CO2) / Vm]×M(CO2); m(H) = n(H)×M(H) = 2×n(H2O)×M(H) = [2×n(H2O) / M(H2O)] ×M(H). Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль; M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль. Тогда, m(C) = [11,2 / 22,4]×44 = 6 г; m(H) = [2×9 / 18] ×1 = 1 г. Определим химическую формулу соединения как CxHy: x:y = m(C)/Ar(C) : m(H)/Ar(H); x:y = 6/12 :1/1; x:y = 0,5 : 1 = 1: 2. Значит простейшая формула соединения CH2 и молярную массу 14 г/моль [M(CH2) = Ar(C) + 2×Ar(H) = 12 + 2×1 = 14 г/моль]. Значение молярной массы органического вещества можно определить при помощи его плотности по кислороду: Msubstance = M(O2) × D(O2); Msubstance = 32 × 1,313 = 42 г/моль. Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс: Msubstance / M(CH2) = 42 / 14 = 3. Значит индексы атомов углерода и водорода должны быть в 3 раза выше, т.е. формула вещества будет иметь вид C3H6. |
| Ответ | C3H6 |











