Плотность сероводорода
Плотность сероводорода и другие его физические свойства
Насыщенный раствор (0,1М) называют «сероводородной водой», который мутнеет при стоянии на воздухе. Плотность сероводорода равна 1,36 кг/м3.
Сероводород образуется при разложении растительных и животных остатков, например яичного белка. Неприятный запах тухлых яиц обусловлен выделением сероводорода. Сероводород содержится во многих минеральных источниках. Особенно им богаты некоторые источники Кавказа (Мацеста, Пятигорск).
Химический состав и строение молекулы сероводорода
Химический состав молекулы сероводорода отражается эмпирической формулой H2S. Структурная (графическая) формула сероводорода является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы (рис. 1).
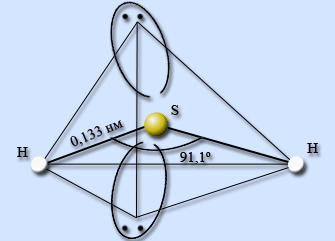
Рис. 1. Строение молекулы сероводорода с указанием валентного угла между связями и длины химических связей.
Строение молекулы сероводорода сходно со строением молекулы воды. Она образована перекрыванием s-электронных облаков атомов водорода с p-электронными облаками атома серы. Так как p-электронные орбитали расположены взаимно перпендикулярно, то перекрывание s- и p-электронных облаков происходит под углом примерно 90oC.
Из-за большой элекроотрицательности серы электронная плотность сдвинута в её сторону: молекула сероводорода имеет не линейное, а угловое строение.
Краткое описание химических свойств и плотность сероводорода
Сероводород энергично реагирует с кислородом:
2H2S + 3O2 = 2H2O + 2SO2;
S-2 →S+4;
O0→O-2.
При охлаждении пламени происходит неполное сгорание:
2H2S + O2 = 2H2O + 2S;
S-2 →S0;
O0→O-2.
Аналогично протекает реакция с хлором:
H2S + Cl2 = 2HCl + S;
S-2 →S0;
Cl0→Cl—.
В этих условиях атомы окислителя (кислорода и хлора) присоединяют электроны и восстанавливаются. Сероводород (точнее, сера со степенью окисления -2) является сильным восстановителем.
Сероводород – очень ядовитый газ. Он разрушает гемоглобин крови, ибо осаждает из него железо в виде соли FeS.
Примеры решения задач
| Задание | Рассчитайте относительные плотности по водороду, кислороду и воздуху газа этилена C2H4. |
| Решение | Для того, чтобы вычислить относительную плотность одного газа по другому, надо относительную молекулярную массу первого газа разделить на относительную молекулярную массу второго газа.
DO2(C2H4) = Mr(C2H4) / Mr(O2); DO2(C2H4) = 28 / 32 = 0,875. Mr(C2H4) = 2 ×Ar(C) + 4 ×Ar(H) = 2 × 12 + 4 × 1 = 24 + 4 = 28. Mr(O2) = 2 ×Ar(O) = 2 × 16 = 32. DH2(C2H4) = Mr(C2H4) / Mr(H2); DH2(C2H4) = 28 / 2 = 14. Mr(H2) = 2 ×Ar(H) = 2 × 1 = 2. |
| Ответ | Относительные плотности этилена по кислороду и водороду равны 0,875 и 14 соответственно. |
| Задание | Вычислите плотность а) по кислороду; б) по азоту; в) по воздуху следующих газов: оксида азота (IV) и фтороводорода HF. |
| Решение | Для того, чтобы вычислить относительную плотность одного газа по другому, надо относительную молекулярную массу первого газа разделить на относительную молекулярную массу второго газа.
Относительную молекулярную массу воздуха принимают равной 29 (с учетом содержания в воздухе азота, кислорода и других газов). Следует отметить, что понятие «относительная молекулярная масса воздуха» употребляется условно, так как воздух – это смесь газов. Mr(HF) = Ar(H) + Ar(F) = 1 + 19 = 20. Dair(HF) = Mr(HF) / Mr(air) = 20 / 29 = 0,69; DO2(HF) = Mr(HF) / Mr(O2) = 20 / 32 = 0,625; DN2(HF) = Mr(HF) / Mr(N2) = 20 / 28 = 0,71. Mr(O2) = 2 ×Ar(O) = 2 × 16 = 32. Mr(N2) = 2 ×Ar(N) = 2 × 14 = 28. 2) Mr(NO2) = Ar(N) + 2 ×Ar(O) = 14 + 2 ×16 = 14 + 32 = 46. Dair(NO2) = Mr(NO2) / Mr(air) = 46 / 29 = 1,59; DO2(NO2) = Mr(NO2) / Mr(O2) = 46 / 32 = 1,44; DH2(NO2) = Mr(NO2) / Mr(N2) = 46 / 28 = 1,64. |
| Ответ | Плотности фтороводорода по воздуху, кислороду и азоту соответственно равны 0,69, 0,625 и 0,71; плотности оксида азота (IV) по воздуху, кислороду и азоту соответственно равны 1,59, 1,44 и 1,64. |











