Плотность этанола
Плотность этанола и другие его физические свойства
Безводный (абсолютный) спирт кипит при 78,37oС. Получаемый в промышленности спирт-ректификат представляет собой смесь 95,5% этанола и 4,4% воды, которая кипит при 78,37oС (смеси определенного состава, кипящие при постоянной температуре, называют азеотропными смесями).
Основные константы этилового спирта приведены в таблице ниже.
Таблица 1. Физические свойства и плотность этанола.
|
Плотность, г/см3 |
0,7893 |
|
Температура плавления, oС |
-114,3 |
|
Температура кипения, oС |
78,4 |
|
Молярная масса, г/моль |
46,069 |
Этанол является составной частью всех алкогольных (спиртных) напитков. Небольшие количества этанола при попадании в организм вызывают возбуждение, большие количества обладают наркотическим или даже токсическим действием. Летальная доза чистого спирта равна 300 г. Обычно в крови содержится около 0,001% этанола. При приеме внутрь спиртных напитков содержание этанола в крови быстро возрастает и достигает максимума примерно через 1,5 часа.
Этанол используется как растворитель, горючее вещество, дезинфицирующее средство, для консервации анатомических препаратов, а также служит исходным сырьем для различных синтезов.
Химический состав и строение молекулы этанола
Общая формула гомологического ряда предельных одноатомных спиртов CnH2n+1OH. Химический состав этилового спирта можно изобразить при помощи эмпирической (C2H5OH) и рациональной (CH3-CH2-OH) формул (рис. 1).
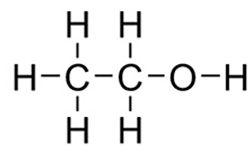
Рис. 1. Строение молекулы этанола
Краткое описание химических свойств и плотность этанола
Этанол проявляет слабые кислотные свойства, которые выражаются в его способности реагировать с щелочными металлами с образованием продуктов – алкоголятов – подобных солям:
2C2H5OH + 2K → 2C2H5OK + H2.
Однако при этом он не взаимодействует с щелочами.
Этанол вступает в реакции этерификации – взаимодействие с карбоновыми кислотами с образованием сложных эфиров в качестве продуктов реакции:
C2H5OH + CH3COOH ↔ CH3COOC2H5 + H2O
Под действием дихромата или перманганата калия этанол окисляется уксусного альдегида, который, в свою очередь, может окисляться в уксусную кислоту;
C2H5OH + [O] → CH3-CH=O + [O] → CH3-COOH
При сильном нагревании этанола с водоотнимающими веществами (концентрированная серная кислота) происходит его внутримолекулярная дегидратация с образованием этилена:
CH3-CH2-OH → CH2=CH2 + H2O.
В случае слабого нагревания этанола с водоотнимающими веществами (концентрированная серная кислота) происходит его межмолекулярная дегидратация с образованием простых эфиров:
2C2H5OH → C2H5-O-C2H5 + H2O.
В обратимых реакциях с галогеноводородами слабые проявляются основные свойства этанола:
C2H5OH + HBr →C2H5Br + H2O.
Примеры решения задач
| Задание | Вычислите плотность по кислороду смеси, состоящей из 55 мл аргона, 150 мл кислорода и 50 мл хлороводорода HCl. |
| Решение | Найдем объемные доли веществ в смеси:
φ = Vgas / Vmixture_gas; φ (Ar) = V(Ar) / Vmixture_gas; φ (Ar) = 55 / (55 + 150 + 50) = 55 / 255 = 0,22. φ (O2) = V(O2) / Vmixture_gas; φ (O2) = 150 / (55 + 150 + 50) = 150 / 255 = 0,59. φ (HCl) = V(HCl) / Vmixture_gas; φ (HCl) = 50 / (55 + 150 + 50) = 50 / 255 = 0,2. Объемные доли газов будут совпадать с молярными, т.е. с долями количеств веществ, это следствие из закона Авогадро. Найдем условную молекулярную массу смеси: Mrconditional (mixture) = φ (Ar) ×Mr(Ar) + φ (O2) ×Mr(O2) + φ (HCl) ×Mr(HCl); Mrconditional (mixture) = 0,22 × 40 + 0,59 × 32 + 0,2 × 36,5. Mrconditional (mixture) = 8,8 + 18,88 + 7,3 = 34,98. Найдем относительную плотность смеси по азоту: DO2(mixture) = Mrconditional (mixture) / Mr(O2); DO2(mixture) = 34,98 / 32 = 1,09. |
| Ответ | Плотность по кислороду смеси, состоящей из аргона, кислорода и хлороводорода равна 1,09. |
| Задание | Плотность по азоту газовой смеси, состоящей из этана C2H6 и пропана C3H8, составляет 9,9. Вычислите условную молекулярную массу смеси газов. |
| Решение | Относительная плотность смеси газов по водороду можно определить по следующей формуле:
DN2(mixture) = Mrconditional (mixture) / Mr(N2) = 9,9. Отсюда, условная молекулярная масса смеси газов равна: Mrconditional (mixture) = DN2(mixture) ×Mr(N2); Mrconditional (mixture) = 9,9 × 28 =277,2. |
| Ответ | Условная молекулярная масса смеси газов равна 277,2. |











