Плотность бензола
Плотность бензола и другие его физические свойства
Основные физические константы бензола приведены в табл. 1. Он широко используется в промышленной органической химии в качестве растворителя и сырья для синтеза красителей, полимеров, взрывчатых веществ, поверхносто-активных веществ, лекарственных препаратов. Бензол растворяет жиры, полимеры, нефтепродукты, масла, лаки.
Таблица 1. Физические свойства и плотность бензола.
|
Плотность, г/см3 |
0,8786 |
|
Температура плавления, oС |
5,5 |
|
Температура кипения, oС |
81 |
|
Температура вспышки, oС |
-11 |
|
Температура самовоспламенения, oС |
562 |
|
Динамическая вязкость, Па×с |
0,0652 |
|
Энергия ионизации, эВ |
9,24 |
Бензол токсичен, вдыхание его паров вызывает острое отравление, приступы головокружения, судороги. При хроническом отравлении бензол поражает почки, печень, костный мозг, приводит к уменьшению в крови эритроцитов.
Химический состав и строение молекулы бензола
Химический состав молекулы бензола можно отразить при помощи эмпирической формулы C6H6. Согласно представлениям современной органической химии, молекула бензола является правильным плоским шестиугольником. Все шесть атомов углерода находятся в sp2-гибридном состоянии. Каждый атом углерода образует σ – связи с двумя атомами углерода и одним атомов водороды, лежащими в плоскости цикла. Валентные углы между тремя σ – связями равны 1200.
Каждый атом углерода в молекуле бензола имеет одну негибридизованнуюp – орбиталь. Шесть этих орбиталей располагаются перпендикулярно плоскому σ – скелету и параллельно друг другу. При их взаимном перекрывании образуется единое π-электронное облако, т.е. осуществляется круговая делокализация электронов. Наибольшая π-электронная плотность в этой сопряженной системе располагается над плоскостью σ – скелета молекулы и охватывает все шесть атомов углеродного цикла. В результате все связи между атомами углерода в бензоле выравнены и имеют длину 0,139 нм (рис. 2).
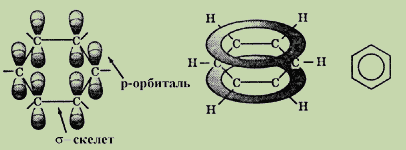
Рис. 2. Строение молекулы бензола.
Краткое описание химических свойств и плотность бензола
Для бензола характерны реакции замещения, протекающие по электрофильному механизму:
— галогенирование (бензол взаимодействует с хлором и бромом в присутствии катализаторов – безводных AlCl3, FeCl3, AlBr3)
C6H6 + Cl2 = C6H5-Cl + HCl
— нитрование (бензол легко реагирует с нитрующей смесью – смесь концентрированных азотной и серной кислот)
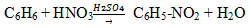
— алкилирование по Фридею-Крафтсу
C6H6 + CH3-CH(CH3)-Cl = C6H5-CH(CH3)-CH3 + HCl.
— алкилирование алкенами
C6H6 + CH2=CH-CH3 → C6H5-CH(CH3)2
Реакции присоединения к бензолу приводят к разрушению ароматической системы и протекают только в жестких условиях:
— гидрирование (реакция протекает при нагревании, катализатор – Pt)
C6H6 + 3H2 = C6H12;
— присоединение хлора (протекает под действием УФ-излучения с образованием твердого продукта – гексахлорциклогексана (гексахлорана) – C6H6Cl6)
C6H6 + 3Cl2 = C6H6Cl6.
Примеры решения задач
| Задание | Вычислите плотность а) по кислороду; б) по азоту; в) по воздуху следующих газов: пропана C3H8 и стибина SbH3. |
| Решение | Для того, чтобы вычислить относительную плотность одного газа по другому, надо относительную молекулярную массу первого газа разделить на относительную молекулярную массу второго газа.
Относительную молекулярную массу воздуха принимают равной 29 (с учетом содержания в воздухе азота, кислорода и других газов). Следует отметить, что понятие «относительная молекулярная масса воздуха» употребляется условно, так как воздух – это смесь газов. Mr(C3H8) = 3 ×Ar(С) + 8×Ar(H) = 3 ×12 + 8×1 = 36 + 8 = 44. Dair(C3H8) = Mr(C3H8) / Mr(air) = 44 / 29 = 1,52; DO2(C3H8) = Mr(C3H8) / Mr(O2) = 44 / 32 = 1,375; DN2(C3H8) = Mr(C3H8) / Mr(N2) = 44 / 28 = 1,57. Mr(O2) = 2 ×Ar(O) = 2 × 16 = 32. Mr(N2) = 2 ×Ar(N) = 2 × 14 = 28. 2) Mr(SbH3) = Ar(Sb) + 3×Ar(H) = 122 + 3×1 = 122 + 3 = 125. Dair(SbH3) = Mr(SbH3) / Mr(air) = 125 / 29 = 4,31; DO2(SbH3) = Mr(SbH3) / Mr(O2) = 125 / 32 = 3,91; DH2(SbH3) = Mr(SbH3) / Mr(N2) = 125 / 28 = 4,46. |
| Ответ | Плотности пропана по воздуху, кислороду и азоту соответственно равны 1,52, 1,375 и 1,57; плотности стибина по воздуху, кислороду и азоту соответственно равны 4,31, 3,91 и 4,46. |
| Задание | Плотность некоторого газа по гелию составляет 10. Известно, что газ является простым веществом. О каком веществе идет речь? |
| Решение | Отношение массы данного газа к массе другого газа, взятого в том же объеме, при той же температуре и том же давлении, называется относительной плотностью первого газа по второму. Данная величина показывает, во сколько раз первый газ тяжелее или легче второго газа.
D = M1 / M2. Молярная масса газа равна его плотности по отношению к другому газу, умноженной на молярную массу второго газа: M1 = D×M2. Тогда, молярная масса газа будет равна: Mgas = DHe× M(He) = 10× 4 = 40г/моль. Среди простых веществ в газообразном состоянии находятся азот, кислород, водород, хлор, неон, гелий, фтор, аргон, криптон, ксенон и радон. Формула молекулы аргона Ar. Относительная атомная масса аргона равна 39,948 а.е.м. Значит искомый газ – это аргон. |
| Ответ | Искомый газ – аргон |











