Молярная масса водяного пара
Молярная масса водяного пара
Он не имеет ни цвета, ни вкуса, ни запаха. Вода – это наиболее распространенное вещество в природе. Помимо существования в виде газа, она также может находиться в жидком или твердом (лед) состоянии, каждое из которых определяется температурой и давлением (рис. 1).
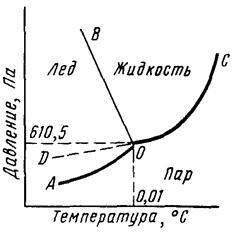
Рис. 1. Диаграмма состояния воды.
Кривая АО соответствует равновесию в системе лед-пар, DO – равновесию в системе переохлажденная вода-пар, кривая OC – равновесию в системе вода-пар, а кривая OB – равновесию в системе лед-вода. В точке О все кривые пересекаются. Эта точка называется тройной точкой и отвечает равновесию в системе лед-вода-пар.
Брутто-формула водяного пара совпадает с брутто-формулой воды и имеет вид 2O. Как известно, молекулярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Mr(H2O) = 2×Ar(H) + Ar(O);
Mr(H2O) = 2×1 + 16 = 2 + 16 = 18.
Молярная масса (М) – это масса 1 моль вещества. Легко показать, что численные значения молярной массы М и относительной молекулярной массы Mr равны, однако первая величина имеет размерность [M] = г/моль, а вторая безразмерна:
M = NA × m (1 молекулы) = NA × Mr × 1 а.е.м. = (NA ×1 а.е.м.) × Mr = × Mr.
Это означает, что молярная масса водяного пара равна 18 г/моль.
Примеры решения задач
| Задание | Сколько граммов цинка вступило в реакцию взаимодействия с соляной кислотой, если образовалось 0,5 г газа водорода? |
| Решение | Запишем уравнение реакции взаимодействия цинка с соляной кислотой:
Zn + 2HCl = ZnCl2 + H2. Найдем молярную массу молекулярного водорода (значение относительной атомной массы, взятое из Периодической таблицы Д.И. Менделеева, округлим до целого числа). Известно, что M = Mr, значит (H2) = 2×Ar(H) = 2×1 = 2 г/моль. Рассчитаем количество вещества водорода: n = m / M; n(H)= m (H)/ M(H); n(H)= 0,5/ 2 =1 моль. Согласно уравнению реакции n(H2) :n(Zn) = 1 : 1, значит, n(Zn) = 1 моль. Найдем молярную массу цинка (значение относительной атомной массы, взятое из Периодической таблицы Д.И. Менделеева, округлим до целого числа). Известно, что M = Mr, значит (Zn) = 65 г/моль. Определим массу цинка: m = n × M; m(Zn) = n (Zn) × M (Zn); m(Zn) = 1 × 65 = 65 г. |
| Ответ | Масса цинка равна 65 г. |
| Задание | Какая масса оксида меди (II) необходима, чтобы при восстановлении водородом получить из неё 128 г меди? |
| Решение | Запишем уравнение реакции восстановления оксида меди (II) водородом:
CuO + H2 = Cu + H2O. Найдем молярную массу меди (значение относительной атомной массы, взятое из Периодической таблицы Д.И. Менделеева, округлим до целого числа). Известно, что M = Mr, значит (Cu) = 64 г/моль. Рассчитаем количество вещества меди: n = m / M; n(Cu)= m (Cu)/ M(Cu); n(Cu)= 128/ 64 =2 моль. Согласно уравнению реакции n(Cu) :n(CuO) = 1 : 1, значит, n(CuO) = 2 моль. Найдем молярную массу оксида меди (II) (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел). Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(CuO) = Ar(Cu) + Ar(O) = 64 + 16 = 80 г/моль. Определим массу оксида меди (II): m = n × M; m(CuO) = n (CuO) × M (CuO); m(CuO) =2 × 80 = 160 г. |
| Ответ | Масса оксида меди (II) равна 160 г |











