Молярная масса серы
Молярная масса серы
Порядковый номер – 16. Строение атома показано на рис. 1. Неметалл p-семейства.
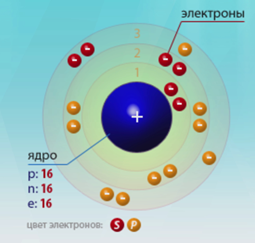
Рис. 1. Схема строения атома серы.
В обычных условиях сера представляет собой хрупкие кристаллы желтого цвета, плавящиеся при температуре 112,8oC. Плотность 2,07 г/см3. Нерастворима в воде, но довольно хорошо растворима в сероуглероде, бензоле и некоторых других жидкостях. При испарении этих жидкостей сера выделяется из раствора в виде прозрачных желтых кристалликов ромбической системы, имеющих форму октаэдров (ромбическая модификация).
Если расплавленную серу медленно охлаждать и в тот момент, когда она частично затвердевает слить еще не успевшую застыть жидкость можно получить длинные темно-желтые игольчатые кристаллы моноклинной системы (моноклинная модификация). Плотность 1,96 г/см3. Температура плавления 119,3oC.
Молярная масса серы равна 32,065 г/моль. Данное значение показывает отношение массы вещества (m) е число моль данного вещества (n), обозначается M и может быть рассчитано по формуле:
M = m / n.
Иными словами, молярная масса вещества – это масса 1 моль данного вещества, выраженная в г/моль или ккмоль.
Поскольку вне зависимости от модификации сера находится в твердом или жидком состоянии, но не газообразном, для нахождения значения её молярной массы нельзя использовать величину молярного объема или производить расчеты по формуле Менделеева-Клапейрона.
Примеры решения задач
| Задание | Какая масса серы потребуется для получения сульфида алюминия Al2S3 массой 30 г? В каких условиях может быть получен этот сульфид из простых веществ? |
| Решение | Запишем уравнение реакции получения сульфида серы:
2Al + 3S = Al2S3. Вычислим количество вещества сульфида алюминия (молярная масса – 150 г/моль): n = m / M; n(Al2S3) = m(Al2S3) / M(Al2S3); n(Al2S3) = 30 / 150 = 0,2моль. Согласно уравнению реакции n(Al2S3) : n(S) = 1:3, значит: n(S) = 3 × n(Al2S3); n(S) = 3 × 0,2 = 0,6 моль. Тогда масса серы будет равна (молярная масса – 32г/моль): m = n × M; m(S) = n(S) × M(S); m(S) = 0,6 × 32 = 19,2г. |
| Ответ | Масса серы 19,2 г |
| Задание | При сжигании серы в кислороде получен оксид серы (IV) объемом при нормальных условиях 5,6 л. Определите массу серы, которая была сожжена. |
| Решение | Запишем уравнение реакции получения оксида серы (IV):
6S + 3O2 = 2SO3. Рассчитаем количество вещества оксида серы (IV): n = V / Vm; n(SO3) = V (SO3) / Vm; n (SO3) = 5,6 / 22,4 = 0,25 моль. Согласно уравнению реакции n(SO3) : n(S) = 2:6, значит: n(S) = 3 × n(SO3); n(S) = 3 × 0,25 = 0,75 моль. Тогда масса серы будет равна (молярная масса – 32г/моль): m = n × M; m(S) = n(S) × M(S); m(S) = 0,75 × 32 = 24г. |
| Ответ | Масса серы равна 24 г |











