Молярная масса метана
Молярная масса метана
Молекула метана имеет тетраэдрическую форму (строение представлено на рис. 1): в гибридизацию вступают все валентные электроны углерода, следовательно, атом углерода находится в sp3-гибридизации.Растворим в этаноле, эфире, углеводородах и мало растворим в воде (45 мл в 1 л воды при 20oС).
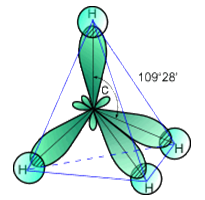
Рис. 1. Строение молекулы метана.
Брутто-формула метана – CH4. Как известно, молекулярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Mr(CH4) = Ar(C) + 4×Ar(H);
Mr(CH4) = 12 + 4×1 = 12 + 4 = 16.
Молярная масса (М) – это масса 1 моль вещества. Легко показать, что численные значения молярной массы М и относительной молекулярной массы Mr равны, однако первая величина имеет размерность [M] = г/моль, а вторая безразмерна:
M = NA × m (1 молекулы) = NA × Mr × 1 а.е.м. = (NA ×1 а.е.м.) × Mr = × Mr.
Это означает, что молярная масса метана равна 16 г/моль.
Молярную массу вещества в газообразном состоянии можно определить, используя понятие о его молярном объеме. Для этого находят объем, занимаемый при нормальных условиях определенной массой данного вещества, а затем вычисляют массу 22,4 л этого вещества при тех же условиях.
Для достижения данной цели (вычисление молярной массы) возможно использование уравнения состояния идеального газа (уравнение Менделеева-Клапейрона):
pV = mRT / M,
где p – давление газа (Па), V – объем газа (м3), m – масса вещества (г), M – молярная масса вещества (г/моль), Т – абсолютная температура (К), R – универсальная газовая постоянная равная 8,314 Дж/(моль×К).
Примеры решения задач
| Задание | Составьте формулу соединения водорода, йода и кислорода, если массовые доли элементов в нём: ω(H) = 2,2%, ω(I) = 55,7%, ω(O) = 42,1%. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле:
ω (Х) = n × Ar (X) / M (HX) × 100%. Обозначим количество моль элементов, входящих в состав соединения за «х» (водород), «у» (йод), «z» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел): x:y:z = ω(H)/Ar(H) : ω(I)/Ar(I) : ω(O)/Ar(O); x:y:z= 2,2/1 : 55,7/127: 42,1/16; x:y:z= 2,2 : 0,44: 2,63 = 5 : 1 : 6. Значит формула соединения водорода, йода и кислорода будет иметь вид H5IO6. |
| Ответ | H5IO6 |
| Задание | Составьте формулу соединения калия, серы и кислорода, если массовые доли элементов в нём: ω(K) = 30,75%, ω(S) = 25,21%, ω(O) = 44,04%. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле:
ω (Х) = n × Ar (X) / M (HX) × 100%. Обозначим количество моль элементов, входящих в состав соединения за «х» (калий), «у» (сера), «z» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел): x:y:z = ω(K)/Ar(K) : ω(S)/Ar(S) : ω(O)/Ar(O); x:y:z= 30,75/39 : 25,21/32: 44,04/16; x:y:z= 0,78 : 0,78: 2,75 = 1 : 1 : 3. Значит формула соединения калия, серы и кислорода будет иметь вид SO3. |
| Ответ | KSO3 |











